
 (1)从不同的角度,化学反应可以有不同的分类方法,不同类别的化学反应间又有一定的联系,请在如图的方框中,用图示(每个圆圈代表一类
(1)从不同的角度,化学反应可以有不同的分类方法,不同类别的化学反应间又有一定的联系,请在如图的方框中,用图示(每个圆圈代表一类分析 (1)化合反应部分是氧化还原反应,离子反应部分是氧化还原反应,离子反应也有部分是化合反应;
(2)氧化还原反应中遵循电荷守恒,从化合物中化合价代数和为0的角度判断R元素的化合价,进而判断最外层电子数.
解答 解:(1)化合反应部分是氧化还原反应,离子反应部分是氧化还原反应,离子反应也有部分是化合反应,其关系如图所示: ,
,
故答案为: ;
;
(2)①在RO3 n-+6I-+6H+═R-+3I2+3H2O中,由电荷守恒得出n=1,设RO3-中R元素的化合价为x,则-2×3+x=-1,x=+5,故答案为:+5;
②R的最低负价为-1价,则最高正价为+7价,则说明最外层含有7个电子,故答案为:7.
点评 本题考查氧化还原反应,为高频考点,本题易错点为R元素原子的最外层电子数的判断,不能根据正化合价判断,当R元素的不处于最高正价时,不能用来判断最外层电子数,题目难度不大


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 某卤代烃与NaOH溶液共热后滴加AgNO3溶液,产生白色沉淀,说明该卤代烃为氯代烃 | |
| B. | 向装有铁粉的烧瓶中加入苯、溴水,可以制取溴苯 | |
| C. | 将乙醇与浓硫酸在170℃时共热产生的气体直接通入KMnO4酸性溶液中,溶液褪色,并不能说明乙醇与浓硫酸在170℃时共热产生了乙烯 | |
| D. | 向苯酚的浓溶液中滴加几滴稀溴水,可以观察到产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He原子核内中子数为2 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{1}^{3}$H是同一元素的不同原子 | |
| C. | ${\;}_{2}^{3}$He核外电子数为2 | |
| D. | ${\;}_{2}^{3}$He代表原子核内有2个质子和3个中子的氦原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
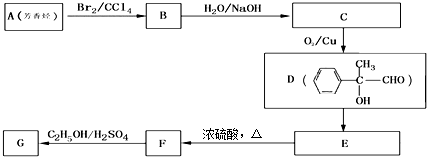
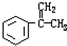
 .③写出所有符合下列条件的F的同分异构体的结构简式:
.③写出所有符合下列条件的F的同分异构体的结构简式: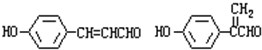 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO可以由Cu和稀硝酸反应制得? | |
| B. | NO不会造成空气污染,是一种无害气体 | |
| C. | NO可以由N2在O2中燃烧制得? | |
| D. | NO是红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
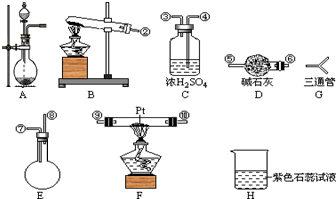 某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.
某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.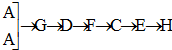 [按装置先后顺序排列]
[按装置先后顺序排列]查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | $\frac{2a}{3}$ | B. | $\frac{44a}{b}$ | C. | $\frac{b}{112a}$ | D. | $\frac{a}{56b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | Fe2+溶液的 体积/mL | |||
| 1 | 20.00 | |||
| 2 | 20.00 | |||
| 3 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com