
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
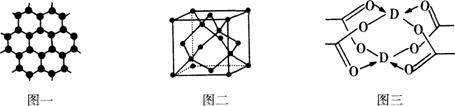 (3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为 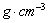 (保留两位有效数字)。(
(保留两位有效数字)。(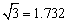 )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图
三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
【知识点】原子核外电子排布、晶胞计算、化学键
【答案解析】
(1)
| ↑↓ | ↑↓ | ↑↓ | ↑ |
3s 3p
(2)HF>HI>HBr>HCl (1分) HF分子之间形成氢键使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子量越大,范德华力越大(2分)
(3)sp2(1分) 34%(2分)
(4)面心立方最密堆积(1分) ①②③(1分)
(5)首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液(1分)
Cu2++2NH3·H2O===Cu(OH)2↓+2NH、Cu(OH)2+4NH3===[Cu(NH3)]2++2OH-(各1分,共2分)
解析:由题意得A为氢元素,B为碳元素,C为氯元素,D为29号元素是铜元素。
电负性最大的是氯元素,M层有7个电子其基态原子的价电子排布图为
| ↑↓ | ↑↓ | ↑↓ | ↑ |
第一电离能最小的是铜元素,填Cu
3s 3p
卤族元素的氢化物沸点由高到低的顺序是HF>HI>HBr>HCl ,HF分子之间形成氢键使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子量越大,范德华力越大,熔沸点较高。
图一中每个碳原子形成3个ρ键,形成3个杂化轨道,所以是sp2杂化。图二为金刚石晶胞中有8个原子,顶点一个、面心三个、晶胞内四个。这样可算原子体积。而晶胞中只有体对角线上的原子是密置的,体对角线与晶胞边长a的关系是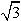 a =8r,算出来的空间利用率是34.0%。
a =8r,算出来的空间利用率是34.0%。
铜晶胞为面心立方最密堆积,图三醋酸铜晶胞中碳氧键、碳氢键为极性键,碳碳键为非极性键,铜氧间是配位键。选 ①②③。
(5)首先形成Cu(OH)2蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。化学反应为:Cu2++2NH3·H2O===Cu(OH)2↓+2NH、Cu(OH)2+4NH3===[Cu(NH3)]2++2OH-
【思路点拨】本题考查原子核外电子排布、晶胞计算、化学键,注意结构的计算,难度中等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
将溶质的质量分数为14%的KOH溶液加热蒸发掉100 g水后,得到溶质的质量分数为28%的溶液80 mL,此时溶液的物质的量浓度为( )
A.5 mol·L-1 B.6.25 mol·L-1
C.7 mol·L-1 D.6.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是( )
A.除去N2中的少量O2:通过灼热的CuO粉,收集气体
B.除去CO2中的少量水蒸气:通入装有碱石灰的干燥管,收集气体
C.除去FeCl2溶液中的少量CuCl2:加入过量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
欲测定某生铁(主要成分是铁,还含有少量的碳)的组成,进行了如下实验:
称取粉末状样品8.5克,加入某浓度的盐酸100 mL ,充分反应后,收集到标准状况下气
体2.24 L ;然后,继续往样品中加入同浓度的盐酸100mL ,充分反应后又收集到标准
状况下气体1.12 L 。
试求:(写出具体计算过程)
(1)所取盐酸的物质的量浓度。
(2)该生铁样品中碳的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
 A、若
A、若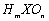 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D、若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净
D.欲使Ca2+离子沉淀最完全,选择Na2CO3作沉淀剂效果比Na2SO4好
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达平衡时,X的转化率为50%
B.反应可表示为:X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用惰性电极电解饱和氯化钠溶液:2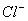 + 2H+
+ 2H+  H2↑+ Cl2↑
H2↑+ Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+ + 2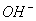

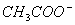 +
+ 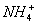 +3NH3 + 3Ag↓+ H2O
+3NH3 + 3Ag↓+ H2O
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2
2C6H5OH + 2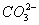
D.Na2SO3溶液使酸性KMnO4溶液褪色:5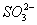 + 6H+ + 2MnO4- == 5
+ 6H+ + 2MnO4- == 5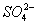 + 2Mn2+ 3H2O
+ 2Mn2+ 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是 ( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com