
【题目】下列气体无毒的是
A. Cl2 B. N2 C. CO D. SO2
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 64gCaC2中含有的共用电子对数为3NA
B. 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA
C. 1mol苯分子中含有碳碳双键数为3NA
D. 100g质量分数为46%的乙醇水溶液中,所含氢原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味。工业上,提纯粗硅的原理如下:
![]()
(1)已知:① Si(s)+4HCl(g)![]() SiCl4(g)+2H2(g) △H1=-241 kJ·mol-1
SiCl4(g)+2H2(g) △H1=-241 kJ·mol-1
②Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g) △H2= -210 kJ·mol-1
SiHCl3(g)+H2(g) △H2= -210 kJ·mol-1
③3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H3= -akJ·mol-1
4SiHCl3(g) △H3= -akJ·mol-1
a=__________。
(2)工业上,利用蒸馏水吸收尾气中的氯化氢制盐酸。常用沉淀滴定法测定盐酸的浓度:取一定体积的盐酸用标准AgNO3溶液滴定,用K2CrO4溶液作指示剂。已知:298 K时Ksp(AgCl)、Ksp(Ag2CrO4)分别为 1.8×10-10、l.0×10-12。
若选择K2CrO4为指示剂,使溶液中c(CrO42-)=0.01 mol·L-1。当产生黄色Ag2CrO4沉淀时,c(Cl-)=__________ mol·L-1。
(3)研究反应③最适合的反应温度,四氯化硅的转化率随温度的变化曲线如图所示。
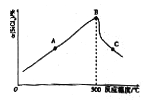
①图像中表示SiHCl3(g)的正反应速率小于SiHCl3(g)的逆反应速率的点是__________(填“A”“B”或“C”)。
②温度低于500℃时,随着温度升高,四氯化硅的转化率增大,其原因是_________________。
(4)一定温度下,向2L恒容密闭器中充入一定量的SiCl4(g)、H2(g)和Si(s)发生反应③,经过tmin达到平衡。测得平衡体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1 mol·L-1。
(i)从反应开始到平衡时SiCl4的平均速率为__________。
(ii)在该条件下,H2的平衡转化率为__________。升髙温度,该反应的平衡常数__________(填“增大”,“减小”或“不变”)。
(iii)若平衡后再向容器中充入与起始时等量的SiCl4(g)和H2(g)(假设硅足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将__________ (填“增大”“减小”或“不变”)。
(iv)若平衡后,将容器的体积压缩至1L(硅足量),再次达到平衡时,H2的物质的量浓度范围为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀,在上述一系列变化过程中,最终被还原的微粒是
A.NO3-B.SO2C.Fe2+D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是
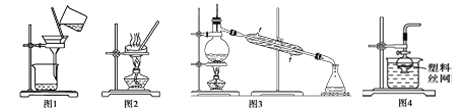
A. 用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B. 用图2所示装置蒸发掉CuCl2溶液中大部分水制得CuCl2·2H2O晶体
C. 用图3所示装置从乙酸和乙酸乙酯的混合液中分离得到纯净的乙酸乙酯
D. 用图4所示装置,用块状大理石与稀盐酸反应制取CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池的原理如右图。下列说法正确的是
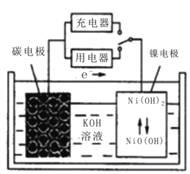
A. 放电时,负极发生还原反应
B. 放电时,正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 放电时,OH-移向镍电极
D. 充电时,将电池的镍电极与外电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究:1-氯丙烷与NaOH乙醇溶液的反应
学习小组在进行1-氯丙烷与NaOH乙醇溶液溶液的反应中,观察到有气体生成。
请你设计两种不同的方法分别检验该气体。在表中的方框中写出装置中所盛试剂的名称(试剂任选) 和实验现象。
图序 | 装置图 | 所盛试剂 | 实验现象 |
1 |
| A是_________ B是_________ | _________ |
2 |
| C是_______________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4。将反应后的混合气体完全燃烧生成CO2和H2O,所需要氧气的物质的量是( )
A.(3m+n)mol B.![]() C.(3m+n+2p)mol D.
C.(3m+n+2p)mol D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠俗称小苏打,其水溶液显____________性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为___________________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者____________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的方法是____________(填“加热”或“溶解过滤”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com