
化学与社会、生活密切相关,下列说法正确的是( )
A. 纳米材料直径一般在几纳米到几十纳米(1nm=10﹣9m)之间,因此纳米材料属于胶体
B. 青铜是我国使用最早的合金
C. SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
D. 明矾与漂白粉都是水处理药品,原理相同
考点: 纳米材料;硅和二氧化硅;合金的概念及其重要应用;镁、铝的重要化合物.
专题: 化学应用.
分析: A、根据胶体的分散质的大小及胶体的定义判断;
B、青铜是我国使用最早的合金;
C、SiO2制成的玻璃纤维,被用于制造通讯光缆与导电能力强弱无关;
D、明矾净水是利用吸附性,漂白粉净水是利用氧化性;
解答: 解:A、胶体是指分散质粒子直径在1 nm~100 nm之间的分散系,胶体是一种分散系,纳米材料只是一种分散质,没有形成分散系,所以不是胶体,故A错误;
B、青铜是我国使用最早的合金,故B正确;
C、二氧化硅具有良好的导光性,则用于制造通讯光缆,与导电能力强弱无关,故C错误;
D、明矾净水是由于水解生成强氧化铝,利用吸附性,漂白粉净水是利用氧化性,二者原理不同,故D错误;
故选B.
点评: 本题考查较为综合,题目难度不大,注意先关知识的积累,注意对纳米材料的理解.


科目:高中化学 来源: 题型:
已知X2、Y2、Z2、W2四种物质的氧化能力强弱顺序为:W2>Z2>X2>Y2,判断下列氧化还原反应,能够发生的是( )
A.2W-+Z2===2Z-+W2 B.2X-+Y2===2Y-+X2
C.2Y-+W2===2W-+Y2 D.2Z-+X2===2X-+Z2
查看答案和解析>>
科目:高中化学 来源: 题型:
)镁铝合金在交通、航空、电子等行业有着广泛的应用。某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。镁铝合金废料转化为硫酸铝晶体实验流程如下:
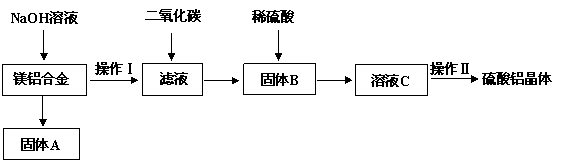
试回答下列问题:
(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式 ▲ ,固体B的化学式 ▲ 。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、 ▲ 、 ▲ 、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 ▲ 。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。计算得硫酸铝晶体的化学式为 ▲ 。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知: 。
。
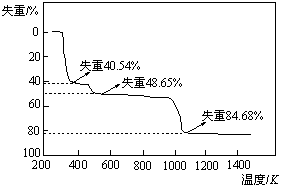 根据图示数据计算确定每步分解的产物,写
根据图示数据计算确定每步分解的产物,写
出第一阶段分解产物的化学式 ▲ ,第三阶段反应化学方程式 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=== +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应: +Ca2++2OH-===CaCO3↓+
+Ca2++2OH-===CaCO3↓+ +2H2O
+2H2O
C.浓盐酸酸化的KMnO4溶液与H2O2反应: +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++ +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为 ;
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+ O2(g)=H2O(g)△H1 K1
O2(g)=H2O(g)△H1 K1
 N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+O2(g)=NO2(g)△H2 K2
 N2(g)+
N2(g)+ H2(g)=NH3(g)△H3 K3
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+ O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
|
| A. | 2△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
|
| B. | 2△H3﹣3△H1﹣2△H2 |
|
| C. | 3△H1+2△H2﹣2△H3 |
|
| D. | 3△H1+2△H2﹣2△H3 3K1+2K2﹣2K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )
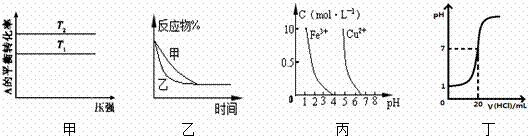
|
| A. | 图甲可以判断出反应A(g)+B(g)⇌若2C(g)的△H<0,T2>T1 |
|
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响.乙的压强比甲的压强大 |
|
| C. | 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH≈4 |
|
| D. | 图丁表示25℃时,用0.1 mol/L叫盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2 |
|
| B. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
|
| C. | 500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2589.6kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切.
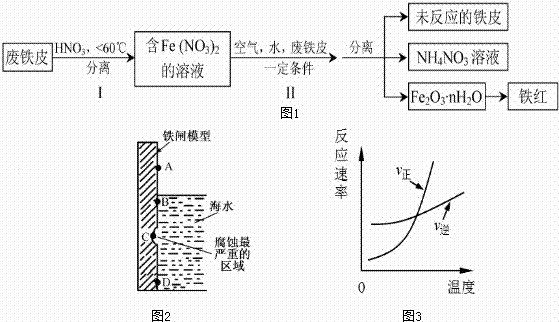
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com