
| A. | 2g氦气所含原子数为NA | |
| B. | 1molD2O所含电子数为12NA | |
| C. | 0.1mol单质铝与足量盐酸反应转移的电子数为0.3NA | |
| D. | 标准状况下,1L水所含分子数为NA |
分析 A.从质量换算为物质的量,结合氦气是氮原子分子分析;
B.D2O分子中所含的质子数为:10;电子数为:10;中子数为:1×2+8;
C.1个铝原子失去3个电子形成铝离子;
D.标准状况下,水是液态不能使用气体摩尔体积22.4L/mol.
解答 解:A.2g氦气物质的量=$\frac{2g}{4g/mol}$=0.5mol,所含原子数为0.5NA,故A错误;
B.D2O分子中D为$\underset{\stackrel{2}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$,D2O所含的质子数为:10;电子数为:10,1molD2O所含电子数为10NA,故B错误;
C.金属铝原子最外层为3个电子,1个铝原子变成铝离子时失去的电子数目为3个,0.1mol单质铝与足量的盐酸反应,失去的电子数0.3 NA,故C正确;
D.标准状况下,水是液态不能使用气体摩尔体积22.4L/mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,气体摩尔体积的应用条件,物质的量与质量的换算,分子与原子的构成关系,注意气体摩尔体积的使用条件与对象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 增加反应物的用量一定能增大反应速率 | |
| B. | 化学反应速率只能加快不能减慢 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 参加反应物质的性质是决定化学反应速率的主要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
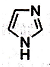 离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示.下列有关咪唑说法不正确的是( )
离子液体在有机合成、无机合成等方面有着重要应用.咪唑是合成“离子液体”的一种原料,其结构如图所示.下列有关咪唑说法不正确的是( )| A. | 化学式C3H4N2 | |
| B. | 分子中含有一种非极性键和两种极性键 | |
| C. | 可以发生取代、加成、氧化反应 | |
| D. | 一氯取代物的同分异构体共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CHCl-CHO | B. | CH3-CHBr-CHBr-CH3 | ||
| C. | CH3-C≡C-CHO | D. | 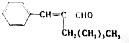 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑩ | ⑥ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | ⑦ | ||
| 4 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点读数时俯视度数 | |
| B. | 酸式滴定管使用前,水洗后未用待测盐酸润洗 | |
| C. | 锥形瓶洗净后未干燥 | |
| D. | 碱式滴定管滴定前尖嘴部分有气泡,滴定后气泡消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com