
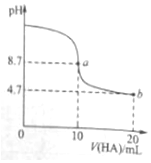
 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(A-)+c(HA)=0.1mol•L-1 | |
| B. | b点所示溶液中c(HA)>c(A-) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | a、b两点所示溶液中水的电离程度a>b |
分析 A.a点溶液总体积为20mL,结合物料守恒分析;
B.b点为等量的NaA、HA,电离大于水解;
C.pH=7时,c(H+)=c(OH-),结合电荷守恒分析;
D.a点溶质为NaA,水解促进电离,而b点HA电离抑制水解.
解答 解:A.a点溶液总体积为20mL,由物料守恒可知,a点所示溶液中c(A-)+c(HA)=0.05mol•L-1,故A错误;
B.b点为等量的NaA、HA,电离大于水解,则b点所示溶液中c(HA)<c(A-),故B错误;
C.pH=7时,c(H+)=c(OH-),由电荷守恒c(H+)+c(Na+)=c(A-)+c(OH-),可知c(Na+)=c(A-),故C错误;
D.a点溶质为NaA,水解促进电离,而b点HA电离抑制水解,则a、b两点所示溶液中水的电离程度a>b,故D正确.
故选D.
点评 本题考查酸碱混合的定性判断,为高频考点,把握混合后溶液的溶质、电离与水解为解答的关键,侧重分析与应用能力的考查,注意电荷守恒及物料守恒的应用,题目难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| D | 证明同温度下氯化银的溶解度大于硫化银的溶解度 | 向2 mL0.1 mol•L-1硝酸银溶液中加入1mL0.1mol•L-1 NaC1溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2═SO42- | |
| C. | 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2溶液中 c(K+)=2c(SO42-) | |
| B. | 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大 | |
| C. | 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-)=c(Br-) | |
| D. | 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸Ka=1.75×10-5 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
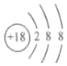

| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
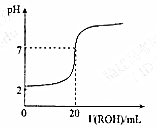 室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )
室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )| A. | V(ROH)<20mL时,随着V(ROH)增大,HM的电离程度减小 | |
| B. | K(HM)=K(ROH) | |
| C. | RM不能发生水解反应 | |
| D. | V(ROH)>20mL时,溶液中c(R+)<c(M-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
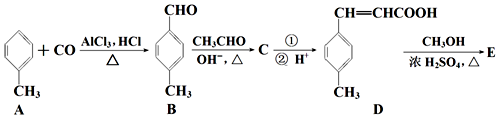
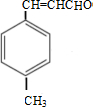 ;D→E的反应类型为酯化反应.
;D→E的反应类型为酯化反应.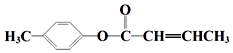 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为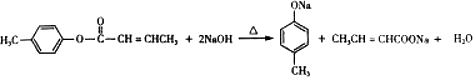 .
.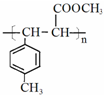 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 试分析它们的原子结构(电子层数、最外层电子)请指出:
试分析它们的原子结构(电子层数、最外层电子)请指出:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
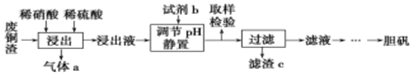
| 离子种类 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com