
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应 TiO2(s)+CCl4(g)
TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
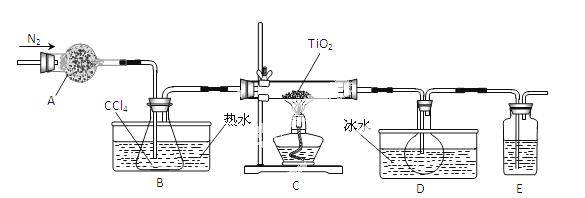
有关物质性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
|
水解 TiOSO4(aq)+ 2H2O(l)== H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
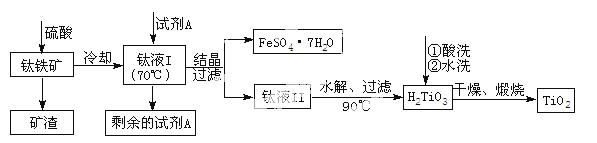
①试剂 A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是 。
A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
有一种有机物的结构简式为:
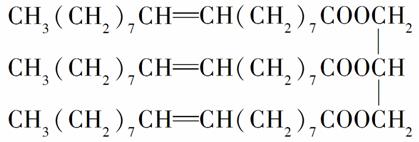
试回答下列问题:
(1)该化合物是________(填选项字母,下同)。
A.烯烃 B.油脂
C.蛋白质 D.糖类
(2)该化合物的密度________。
A.比水大 B.比水小
C.与水相同
(3)常温下该化合物呈________。
A.液态 B.固态
C.气态
(4)下列物质中,能与该物质反应的有________。
A.NaOH(aq) B.溴水
C.乙醇 D.乙酸
E.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机物性质的说法正确的是
A.蛋白质可以与酸、碱或重金属盐反应 B.芳 香烃都不能使酸性KMnO4溶液褪色
香烃都不能使酸性KMnO4溶液褪色
C.CH3CH2OH与氢溴酸不能反应 D.石油的分馏可获得乙烯、丙烯等不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”是将反应物全部转化为期望产物,以使原子利用率达到100%,而尽量减少有害物质生成的化学工艺理念。下列符合“绿色化学”要求的工艺原理是( )
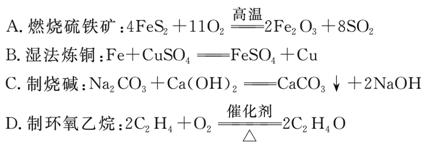
查看答案和解析>>
科目:高中化学 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
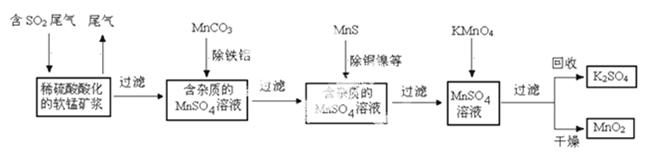
请回答下列 问题:
问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生 成无水MnSO4的热化学方程式是________________。
成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的 SO2只与软锰矿浆中的
SO2只与软锰矿浆中的 MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、
MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气,某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下图所示(部分导管、蒸馏水略)。
a.Na2O2 b.浓盐酸 c.碱石灰 d.NaOH溶液 e.淀粉KI溶液 f.CaCO3 g.石蕊试液 h.饱和NaCl溶液
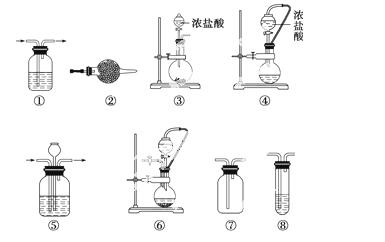
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式_____________________________
______________________________________________________________________。
(2)下表中的装置组合最合理的是__________(填序号,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为__ _____________________________________________________________________。
_____________________________________________________________________。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①_____________________________________________________________________,
②_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以黄铜矿(主要成分为CuFeS2,含少量 杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
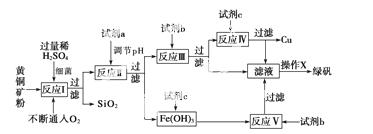
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)反应Ⅰ的化学反应方程式为___________________________________________。
该反应中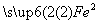 被________(填“氧化”或“还原”),其目的是____________________。
被________(填“氧化”或“还原”),其目的是____________________。
(2)试剂a是__________,具体操作为____________,目的是
_____________________________________________________________________。
(3)反应Ⅲ的离子方程式为_______________________________________________。
试剂c参与反应的离子方程式分别为______________________________________、
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的分子式为C10H14,它不能使溴水褪色,但可使KMnO4酸性溶液褪色,分子结构中只含有一个烷
基,符合条件的烃有 ( )
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中,化学反应前后肯定没有发生改变的是 ( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量
⑤物质的种类 ⑥原子的种类
A.①③④⑤ B. ①③④⑥ C.①④⑥ D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com