
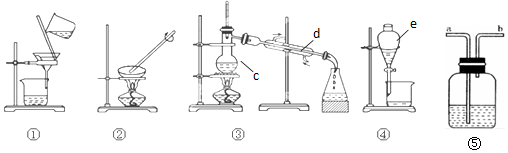
分析 (1)由图可知仪器的名称;
(2)Ⅰ.可用蒸发结晶的方法制备晶体;
Ⅱ.可用过滤的方法除去固体不溶物,可用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
Ⅲ.分离碘水中的碘,应先萃取,再进行蒸馏分离.
解答 解:(1)由图可知装置中d、e的名称分别为冷凝管、分液漏斗,故答案为:冷凝管;分液漏斗;
(2)Ⅰ.用食盐溶液制备 NaCl 晶体,可采用蒸发结晶的方法,故答案为:②;
Ⅱ.可用过滤的方法除去固体不溶物,氯化氢可与碳酸氢钠反应生成二氧化碳,且二氧化碳不溶于饱和碳酸氢钠溶液,可用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体,故答案为:①;碳酸氢钠;
Ⅲ.分离碘水中的碘,应先萃取,用④装置,再③装置中进行蒸馏分离,故答案为:萃取;③;蒸馏.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的使用、混合物分离提纯实验装置及应用为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | Ag+、Na+、Cl-、K+ | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3:2:1 | |
| B. | n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 | |
| D. | 5.6 g CO和22.4 L CO2中含有的碳原子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 叙述I | 叙述II |
| A.NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| B.往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C.水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| D.利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g C2H6中含有的共用电子对数为6NA | |
| B. | 1.0L 1.0mol•L-1Na3PO4水溶液中含有的氧原子数为4NA | |
| C. | 1 mol FeI2与足量氯气反应转移的电子数为3NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com