
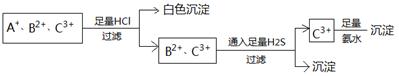
| A.Ag+、Fe2+、Al3+ | B.NH4+、Fe2+、Fe3+ |
| C.Ag+、Cu2+、Fe3+ | D.Ag+、Cu2+、Al3+ |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.Fe2+ | C.Al3+ | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
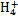 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C 、S
、S 、S
、S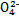 、Cl-、N
、Cl-、N 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
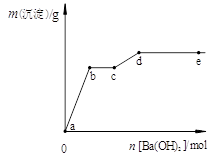
| A.a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B.b→c时发生的离子反应为:H+ + OH— → H2O |
| C.c→d时离子的物质的量:Ba2+可能大于Cl— |
| D.d→e时离子的物质的量:Ba2+一定大于OH— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
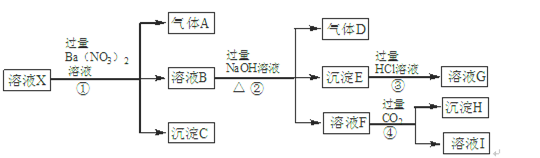
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
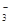 、SO
、SO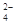 、NH
、NH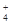 、CO
、CO (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+一定存在 |
| B.100 mL溶液中含0.01 mol CO32- |
| C.Cl-一定存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com