
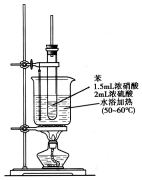
 ����������һ�־��п�������ζ����ɫ��״Һ�壬�ܶȱ�ˮ��������Ⱦ�ϵ���Ҫԭ�ϣ�ʵ��������ͼ��ʾ��װ������ȡ��
����������һ�־��п�������ζ����ɫ��״Һ�壬�ܶȱ�ˮ��������Ⱦ�ϵ���Ҫԭ�ϣ�ʵ��������ͼ��ʾ��װ������ȡ��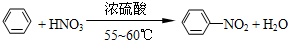 ��
�� ���������������IJ����½���д����������Ӧ�Ļ�ѧ����ʽ
���������������IJ����½���д����������Ӧ�Ļ�ѧ����ʽ +H2SO4��Ũ��$\stackrel{��}{��}$
+H2SO4��Ũ��$\stackrel{��}{��}$ +H2O��
+H2O������ ��1��Ũ����ϡ�ͷų��������ȣ�Ӧ��Ũ���ᵹ��������Һ�У�
��2��ˮԡ������ʹ��Ӧ�����Ⱦ��ȣ��������ܵ�����������������
��3�����Թܵķ�ӦΪ����Ũ������Ũ�����������������������
��4��Ũ���������Ϊ����ˮ������ӦΪ����Ũ�������ɱ������ȡ����Ӧ��
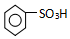
��5������Ũ�����ֽ⣬�������Ƶõ��������к�����������ֽ�����Ķ���������
��6�����ᴿ�������Ĺ����У������������ᣬ����Ӧ���������б��������������ܣ����ݷ������ֲ����ܺͻ��ܵ�Һ��ķ������в�����
��� �⣺��1��Ũ����ϡ�ͷų��������ȣ�Ӧ��Ũ���ᵹ��������Һ�У���Ӧ�ȼ�ŨHNO3��
�ʴ�Ϊ��ŨHNO3��
��2��ˮԡ������ʹ��Ӧ�����Ⱦ��ȣ����ڿ����¶ȣ��������ܵ�����������������
�ʴ�Ϊ����Ӧ�����Ⱦ��ȣ��������¶ȣ�������������
��3����ʹ�ݵķ�ӦΪ�� ��
��
�ʴ�Ϊ�� ��
��
��4��Ũ���������Ϊ����ˮ������ӦΪ����Ũ�������ɱ������ȡ����Ӧ�� +H2SO4��Ũ��$\stackrel{��}{��}$
+H2SO4��Ũ��$\stackrel{��}{��}$ +H2O��
+H2O��
�ʴ�Ϊ��������ˮ�� +H2SO4��Ũ��$\stackrel{��}{��}$
+H2SO4��Ũ��$\stackrel{��}{��}$ +H2O��
+H2O��
��5������Ũ�����ֽ⣬�������Ƶõ��������к�����������ֽ�����Ķ���������
�ʴ�Ϊ��NO2��
��6�����ᴿ�������Ĺ����У������������ᣬ����Ӧ���������б��������������ܣ����Բ�������Ϊ���ٽ���������ת�Ƶ�ʢ������������Һ���ձ���ϴ�Ӣ��÷�Һ©�����з����ˮϴ���÷�Һ©�����з���ݸ��������
�ʴ�Ϊ��C��
���� ���⿼�����Ʊ���������ƣ���Ŀ�Ѷ��еȣ���ȷ�Ʊ�ԭ��Ϊ���ؼ���ע�����������Ʊ������ͷ����ᴿ�����������ԭ�������ֿ�����ѧ���ķ�����������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Һ���ӷ����ڴ��Һ����Լ�ƿ��Ӧ��ˮ�� | |
| B�� | ����ϡ���������ɫ��ζ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ���ԭ��Һ��һ����CO32- | |
| C�� | ��ij��Һ�м���CCl4��CCl4������ɫ��֤��ԭ��Һ�д���I- | |
| D�� | ����ϡ�����ữ��AgNO3��Һ��������ɫ��������ԭ��Һ��һ������Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L HF�к��еķ�ԭ����ĿΪNA | |
| B�� | 0.1 mol/L��NH4HSO4��Һ�еμ�0.1 mol/L��Ba��OH��2��Һ�������պ���ȫ��c ��NH4+����c ��OH-����c ��SO42-����c ��H+�� | |
| C�� | 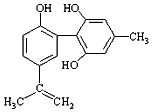 1mol��ͼ������Ũ��ˮ��Ӧʱͨ���������Br2Ϊ4mol | |
| D�� | �����£���ӦC��s��+CO2��g��=2CO��g�������Է����У���÷�Ӧ�ġ�H��0��һ�������£�ʹ�ô����ܼӿ췴Ӧ���ʲ���߷�Ӧ ���ƽ��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
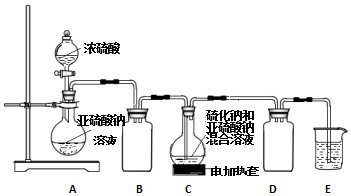
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
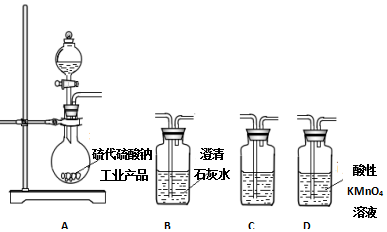
�鿴�𰸺ͽ���>>
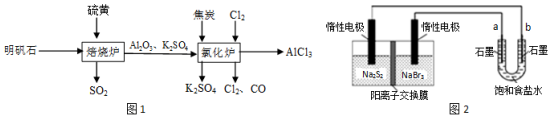
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
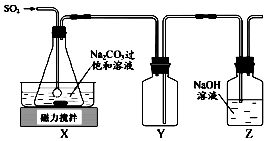 ���������ƣ�Na2S2O5���dz��õĿ����������ڿ����У�����ʱ���ֽ⣮ʵ�����Ʊ�����Na2S2O5�ķ������ڲ��Ͻ����£����Ʒ�Ӧ�¶���40�����ң���Na2CO3��������Һ��ͨ��SO2��ʵ��װ����ͼ��ʾ��
���������ƣ�Na2S2O5���dz��õĿ����������ڿ����У�����ʱ���ֽ⣮ʵ�����Ʊ�����Na2S2O5�ķ������ڲ��Ͻ����£����Ʒ�Ӧ�¶���40�����ң���Na2CO3��������Һ��ͨ��SO2��ʵ��װ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 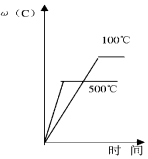 | B�� | 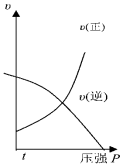 | C�� | 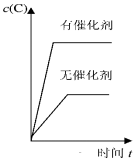 | D�� | 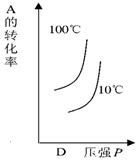 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��101 kPaʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ������������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2��g��+O2��g���T2H2O��l����H=-285.8 kJ•mol-1 | |
| B�� | ��֪C��ʯī��s��=C�����ʯ��s����H��0������ʯ��ʯī�ȶ� | |
| C�� | ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-53.7kJ/mol��������0.1mol����ϡ��Һ�뺬0.1mol�������Ƶ�ϡ��Һ��ϣ��ų�������С��5.73kJ | |
| D�� | ��֪2C��s��+2O2��g���T2CO2��g����H1 2C��s��+O2��g��=2CO��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com