
| A. | 该饱和溶液硫酸铜物质的量浓度为c=$\frac{4a}{v}$ mol•L-1 | |
| B. | 该饱和溶液中硫酸铜的质量分数为w=$\frac{16a}{a+b}$% | |
| C. | 25℃硫酸铜的溶解度为 S=$\frac{1600a}{9a+25b}$g | |
| D. | 该饱和硫酸铜溶液的密度为ρ=$\frac{a+b}{v}$g•L-1 |
分析 A.根据硫酸铜物质的量浓度c=$\frac{n}{V}$来计算;
B.饱和溶液中硫酸铜的质量分数为ω=$\frac{溶质质量}{溶液质量}$×100%;
C.根据溶解度的概念列式计算;
D.饱和硫酸铜溶液的密度ρ=$\frac{m}{V}$来计算.
解答 解:A.a g硫酸铜晶体(CuSO4•5H2O)的物质的量n=$\frac{m}{M}$=$\frac{a}{250}$mol,硫酸铜物质的量浓度c=$\frac{n}{V}$=$\frac{\frac{a}{250}}{V×1{0}^{-3}}$mol/L=$\frac{4a}{V}$mol/L,故A正确;
B.饱和溶液中硫酸铜的质量分数为ω=$\frac{溶质质量}{溶液质量}$×100%=$\frac{ag×\frac{160}{250}}{(a+b)g}$×100%=$\frac{16a}{25(a+b)}$×100%,故B错误;
C.设硫酸铜的溶解度为S,则$\frac{ag×\frac{160}{250}}{b}=\frac{S}{100}$,解得 S=$\frac{1600a}{9a+25b}$g,故C正确;
D、饱和硫酸铜溶液的密度ρ=$\frac{m}{V}$=$\frac{a+b}{V×1{0}^{-3}}$g.L-1,故D正确.
故选B.
点评 本题考查了溶液中质量分数、溶解度以及物质的量浓度的计算,难度中等,侧重于考查学生的分析能力和计算能力,注意把握有关公式.


科目:高中化学 来源: 题型:选择题
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数 | |
| C. | 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深 | |
| D. | 容器Ⅰ中 H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氖元素的相对原子质量是a | |
| B. | 该氖原子的摩尔质量是aNAg | |
| C. | Wg该氖原子的物质的量一定是$\frac{W}{{a{N_A}}}$mol | |
| D. | Wg该氖气的体积是22.4$\frac{W}{{a{N_A}}}$升 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
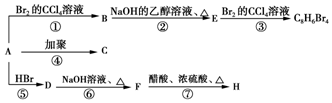
 .
. ,D
,D ,E
,E ,H
,H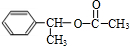 .
. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2和HCl; Cu(OH)2和CH3COOH | |
| B. | Ba(OH)2和MgSO4; BaCl2和(NH4)2SO4 | |
| C. | Na2CO3和H2SO4; K2CO3和NaHSO4 | |
| D. | CaCO3和HCl; Na2CO3和HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com