
【题目】KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,某同学先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作
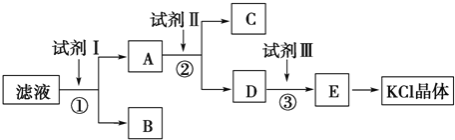
(1)试剂Ⅰ的化学式为__________,其作用是除去__________(填离子符号),
检验该离子完全除尽的操作是__________________________________________
(2)加入试剂Ⅱ时发生反应的化学方程式为_____________________________
(3)试剂Ⅲ的名称是__________,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用__________(填字母).
A.AgNO3 B.pH试纸 C.K2CO3溶液
【答案】BaCl2或Ba(OH)2 SO42- 静置,取少量上层澄清溶液于试管中,再滴加BaCl2 或Ba(OH)2溶液,若无白色沉淀产生在,则原溶液中SO42- 完全除尽;反之,则未除尽 BaCl2 + K2CO3 = BaCO3↓+ 2KCl (或Ba(OH)2+K2CO3=2KOH+BaCO3↓) 盐酸 B
【解析】
KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,除去不溶于水的杂质,滤液中含有可溶性的杂质KOH、K2SO4,由流程可知,滤液中加试剂I为足量的BaCl2或Ba(OH)2,生成硫酸钡沉淀,除去硫酸根离子,操作①为过滤,分离出B为BaSO4,滤液A含BaCl2(或Ba(OH)2)、KOH、KCl,加试剂II为K2CO3,除去过量的钡离子,操作②为过滤,分离出C为BaCO3,D中含KCl、KOH、K2CO3,试剂III为盐酸,再加适量盐酸,③中发生K2CO3+2HCl=2KCl+H2O+CO2↑,KOH+HCl=KCl+H2O,得到E为KCl溶液,再蒸发结晶得到KCl晶体,据此解答。
KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,除去不溶于水的杂质,滤液中含有可溶性的杂质KOH、K2SO4,由流程可知,滤液中加试剂I为足量的BaCl2或Ba(OH)2,生成硫酸钡沉淀,除去硫酸根离子,操作①为过滤,分离出B为BaSO4,滤液A含BaCl2(或Ba(OH)2)、KOH、KCl,加试剂II为K2CO3,除去过量的钡离子,操作②为过滤,分离出C为BaCO3,D中含KCl、KOH、K2CO3,试剂III为盐酸,再加适量盐酸,③中发生K2CO3+2HCl=2KCl+H2O+CO2↑,KOH+HCl=KCl+H2O,得到E为KCl溶液,再蒸发结晶得到KCl晶体,
(1)由以上分析知,试剂Ⅰ的化学式为BaCl2或Ba(OH)2,其作用是除去SO42-,检验该离子完全除尽的操作是静置,取少量上层澄清溶液于试管中,再滴加BaCl2或Ba(OH)2溶液,若无白色沉淀产生在,则原溶液中SO42- 完全除尽,反之,则未除尽;
故答案为:BaCl2或Ba(OH)2;SO42-;静置,取少量上层澄清溶液于试管中,再滴加BaCl2或Ba(OH)2溶液,若无白色沉淀产生在,则原溶液中SO42- 完全除尽,反之,则未除尽;
(2)试剂II为K2CO3,除去过量的钡离子,则加入试剂Ⅱ时发生反应的化学方程式为BaCl2 + K2CO3 = BaCO3↓+ 2KCl或Ba(OH)2+K2CO3=2KOH+BaCO3↓;
故答案为:BaCl2 + K2CO3 = BaCO3↓+ 2KCl或Ba(OH)2+K2CO3=2KOH+BaCO3↓;
(3)试剂Ⅲ的名称是盐酸,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用pH试纸,而加硝酸银、碳酸钾会引入新杂质,不宜检验是否过量,
故答案为:盐酸;B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:

(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”),钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_________________________________。
Ⅱ.利用化学反应:2FeCl3+Cu=2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择________作正极材料,________作负极材料;选择________作电解质溶液。
(2)写出有关的电极反应式:正极:__________________;负极:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(2)在一定的温度和压强下,1体积 X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________。
(3)将50 mL 0.1 mol·L![]() 的NaCl和100 mL 0.05 mol·L
的NaCl和100 mL 0.05 mol·L![]() CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
(4)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO42-,则n(SO42-)为_________。
(5)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(6)标准状况下,NH3与CH4组成的混合气体的密度为0.75g/L,该混合气体的平均摩尔质量为_____________,NH3的体积分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.质子数相同而中子数不同的同一种元素的不同原子互为同素异形体
B.铁是人体必需微量元素中含量最多的一种
C.在水溶液中能导电的物质一般是电解质,如HCl、H2O 、NH3、CH3COOH、NaOH、AgCl都是电解质
D.元素周期表中每一个纵列为一个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一块未打磨过的铝片放入装有少量NaOH溶液的试管中,会发现开始没有气泡,一段时间后才产生气泡。请写出发生反应的离子方程式:___________,___________。
(2)将8gFe2O3投入到150mL某浓度的稀H2SO4中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe与Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为________。
(3)请写出制备漂白粉的离子方程式:____________。
(4)配平下列离子方程式:______Fe(OH)3+ClO-+OH-=FeO42-+Cl-+H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
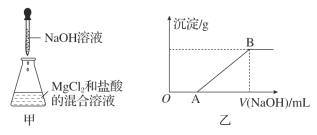
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有________ (填字母)。
a. 天平 b. 烧杯 c. 漏斗 d. 玻璃棒
(2)OA段反应的化学方程式为_____________________________________。
(3)AB段反应的化学方程式为________________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是______________________,反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
A. (NH3)= 0.002mol/(L·s)B. (O2)= 0.01mol/(L·s)
C. (NO)= 0.008mol/(L·s)D. (H2O)= 0.004mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)易与C发生化学反应的酸是________,反应的化学方程式是_______________ 。
(2)将C与纯碱混合,在高温熔融时发生化学反应也可生成D,同时还生成B的最高价氧化物E;将E与D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:____________________、__________________。
②要将纯碱在高温下熔化,下列坩埚中不可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
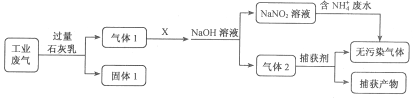
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com