
| A. | NO2为酸性氧化物 | |
| B. | H2O很稳定是因为水分子之间存在氢键 | |
| C. | 反应③中每生成22.4 LN2,转移电子数1.5NA | |
| D. | NH3的沸点比PH3的沸点高 |
分析 A.二氧化氮与碱反应生成硝酸盐、水外,还生成了NO;
B.水稳定是由于水分子中的氢氧共价键稳定,与氢键无关;
C.根据氮元素化合价的变化来分析,且不是标况下;
D.利用相对分子质量分析分子间作用力,并注意氨气分子中有氢键.
解答 解:A.酸性氧化物与碱反应生成盐和水,而二氧化氮与碱反应还生成NO气体,所以二氧化氮不属于酸性氧化物,故A错误;
B.水分子的稳定性与共价键有关,而氢键影响水的沸点,故B错误;
C.N元素的化合价变化为NO中+2→0化合价降低,NO2中+4→0化合价降低,NH3中-3→0化合价升高,每生成标况下的22.4LN2,转移电子数3NA,故C错误;
D.因结构相似时,相对分子质量越大,分子间作用力越大,但氨气分子间还存在氢键,则NH3的沸点高于PH3,故D正确;
故选D.
点评 本题考查氮的氧化物、氮气、有关氮元素的氧化还原反应以及物质熔沸点的比较,题目难度中等,侧重考查物质的结构与性质,明确氢键与化学键的关系为解答关键.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应2A (s)+B (g)═2C (g)+D (g)不能自发进行,则该反应△H一定大于0 | |
| B. | 101kPa时,2 H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| C. | C (石墨,s)═C (金刚石,s)△H1=+1.9kJ•mol-1,则由石墨制取金刚石的吸热反应,金刚石比石墨稳定 | |
| D. | 0.5molH2SO4与0.5mol Ba(OH)2完全反应所放出的热量即为中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子总数、中子总数都相等 | B. | 气体的质量相等 | ||
| C. | 所含原子总数、质子总数都相等 | D. | 所含分子总数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 49个 | B. | 50个 | C. | 51个 | D. | 102个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取0.5 L溶液,Na+的浓度是0.5 mol/L | |
| B. | 取0.1 L溶液稀释至l L,SO42-离子浓度是0.05 mol/L | |
| C. | 溶质的离子总数是6.02×1023个 | |
| D. | 该溶液是把0.5 mol Na2SO4溶于1 L水中配制而成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.1000mol•L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
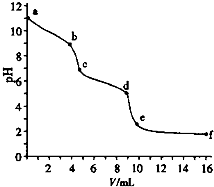 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )| A. | a处发生的离子反应:CO32-+H2O=HCO3-+OH- | |
| B. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应:CO32-+H+=HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com