
| A. | 滴定时,装未知浓度的NaOH溶液锥形瓶忘记用NaOH溶液润洗 | |
| B. | 酸式滴定管用蒸馏水洗后,忘记用盐酸润洗 | |
| C. | 滴定前,滴定管的尖嘴处有气泡,而在滴定后气泡消失 | |
| D. | 滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确 |
分析 根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A、滴定时,装未知浓度的NaOH溶液锥形瓶忘记用NaOH溶液润洗,NaOH的物质的量不变,不影响消耗的标准液的体积,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知不影响测定结果,故A错误;
B、酸式滴定管用蒸馏水洗后,忘记用盐酸润洗,盐酸被稀释,导致消耗的标准液体积偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知测定结果偏大,故B正确;
C、滴定前,滴定管的尖嘴处有气泡,而在滴定后气泡消失,导致消耗的标准液体积偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知测定结果偏大,故C正确;
D、滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确,滴定时消耗的标准液体积偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知测定结果偏小,故D错误;
故选BC.
点评 本题主要考查了化学实验操作中的误差分析,题目难度中等,掌握实验的原理及正确的误差分析是解题的关键,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
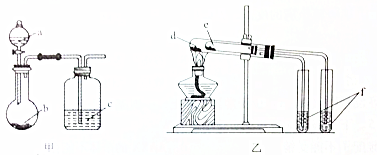
| 选项 | 实验试剂 | 实验结论 | ||
| A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
| B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
| C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
| D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液 |
② | 20mL 0.2mol·L﹣ | 30mL 0.01mol·L﹣1KMnO4溶液[来 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
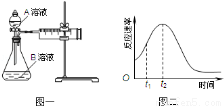
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是: .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
①容量瓶 ②蒸馏烧瓶 ③量筒 ④烧杯 ⑤分液漏斗 ⑥托盘天平
(1)加热时必须垫石棉网的有:_______________,
(2)使用时必须检查是否漏水的有:________________,
(3)标有温度的有:_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
在4℃时向100mL水中溶解了22.4L HCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是
A.该溶液物质的量浓度为10m ol·L-1
ol·L-1
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(OH-) | B. | c(NH4+)+c(NH3•H2O)=0.2 mol•L-1 | ||
| C. | c(NH3•H2O)>c(NH4+) | D. | c(NH4+)+c(H+)=0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱滴定管装标准溶液前,必须先用该溶液润洗 | |
| B. | 滴定过程中眼睛应注视滴定管内液面变化 | |
| C. | 锥形瓶用蒸馏水洗涤后直接盛放待测液,对滴定结果无影响 | |
| D. | 用50mL酸式滴定管可准确量取25.00LHCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com