
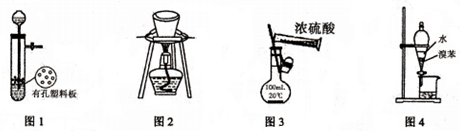
| A. | 图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 图3所示装置配制100mL0.1mol•L-1的硫酸 | |
| D. | 图4所示装置用于分离出溴苯 |
分析 A.Cu和浓H2SO4在加热条件下反应;
B.碳酸氢钠不稳定,加热易分解;
C.不能在容量瓶中直接稀释溶液;
D.溴苯和水互不相溶.
解答 解:A.Cu和浓H2SO4在加热条件下反应,常温下不反应,故A错误;
B.碳酸氢钠不稳定,加热易分解,不能用加热的方法除杂,否则影响碳酸氢钠,故B错误;
C.容量瓶只能在常温下使用,且只能用来配制溶液,不能在容量瓶中直接稀释溶液,故C错误;
D.溴苯和水互不相溶,可用分液的方法分离,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的制备、分离以及溶液的配制,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价.


科目:高中化学 来源: 题型:解答题
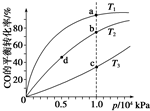 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g C3H6中含有的共用电子对数目为8NA | |
| B. | 2g CaCO3和8g KHCO3组成的混合物中碳原子数为0.1 NA | |
| C. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA | |
| D. | 1L 0.01mol•L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
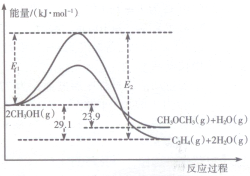 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
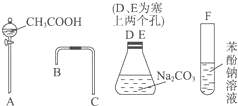 设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.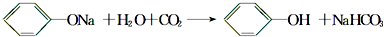 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)}$ | |
| C. | 2c1<1.5 | |
| D. | 2ρ1=ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1 mol.L-1SO2的溶液.中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、N03-、SO42- | |
| C. | $\frac{C{(H}^{+})}{C({OH}^{-})}$=10-12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
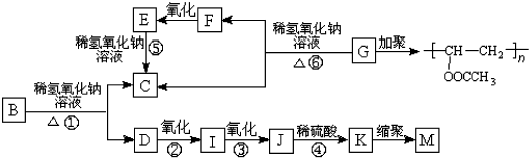
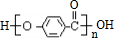 .
.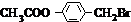 +3NaOH$→_{△}^{水}$CH3COONa+
+3NaOH$→_{△}^{水}$CH3COONa+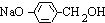 +NaBr+H2O,
+NaBr+H2O,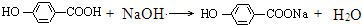 .
.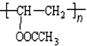 在氢氧化钠溶液中加热:
在氢氧化钠溶液中加热: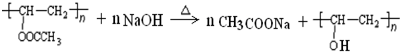 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com