
(7分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。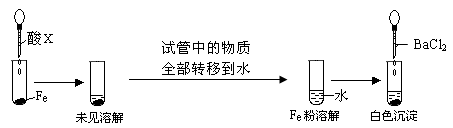
a.浓盐酸 b.浓硫酸 c.浓硝酸
(7分)(1) Cu+H2O2+2HCl ="=" CuCl2+2H2O(2分)
(2)大于(1分);3Cu+8H++2NO3— ="=" 3Cu2++2NO↑+4H2O(2分)
(3)b(2分)
解析试题分析:(1)在氧化剂过氧化氢的作用下把铜氧化成了铜离子,过氧化氢被还原为水,故方程式为: Cu+H2O2+2HCl ="=" CuCl2+2H2O;(2)铜只与浓硫酸反应,与稀硫酸不反应,故被还原的硫酸为0.9mol,反应掉的硫酸为1.8mol,反应后的溶液中还存在硫酸,故反应前硫酸的物质的量大于1.8mol,溶液的体积大于100ml;溶液中有氢离子,加入硝酸盐提供硝酸根离子,氢离子和硝酸根离子把铜氧化,故方程式为:3Cu+8H++2NO3— ="=" 3Cu2++2NO↑+4H2O(2分);(3)铁和浓盐酸反应,排除a;铁放入浓硫酸、浓硝酸中,常温下钝化,把试管中的物质转移到水中,把浓硫酸稀释,铁粉和稀的硫酸反应生成硫酸亚铁,加入氯化钡生成硫酸钡沉淀,而铁和稀的硝酸反应生成硝酸铁,加氯化钡不反应;故选B。
考点:铜和浓硫酸的反应、铁和浓硫酸、浓硝酸的反应、铜和硝酸的反应等知识。


科目:高中化学 来源: 题型:单选题
在8.08g铁与铜的混和物中,加入200mL 0.6mol/L的稀硝酸,充分反应后剩余金属5.44g。再向其中加入50mL 0.4mol/L的稀硫酸,充分振荡后剩余金属4.48g。若硝酸的还原产物只有NO,下列说法正确的是
| A.剩余的5.44g金属为铁 | B.剩余5.44g金属为铜 |
| C.共生成NO气体 0.03mol | D.8.08g金属中铁的质量分数为0.208 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |

 CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
〔化学—选修2:化学与技术〕(15分)
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。

部分物质的相关性质如下:
| | 熔点/℃ | 沸点/℃ | 备注 |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)(2012?重庆)金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子.碳元素在周期表中的位置是 ,Q是 ,R的电子式为 .
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为 ,除去粗产品中少量钠的试剂为 .
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L.生成氢气的离子方程式为 ,硅酸盐的物质的量浓度为 .
(4)下列叙述正确的有 (填序号).
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去)。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
⑴ 物质F的化学式 。
⑵ 物质B的电子式 。
⑶ 写出C→E的化学方程式 。
⑷ 写出G→E的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:__________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2的原因:__________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下的气态化合物,C为常温下的液态化合物,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式为 ,B的电子式为 。
(2)写出下列反应的化学方程式:
D+G→H 。
F+J→B+C+I 。
(3)0.3 mol I与足量C反应转移电子的物质的量为 mol。
(4)容积为10 mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为 mL, mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为________(填字母),能验证CO氧化产物的现象是________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A―→E―→D―→B―→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应________,活塞b应________,需要加热的仪器装置有________(填代号),m中反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com