
【题目】(1)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是__________;1 mol该配离子中含σ键数目为________。
②该配合物中存在的作用力类型有_________(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(2)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为a nm。则硼原子与磷原子最近的距离为__________。 用M g·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为__________g·cm-3。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中3原子1的坐标为(1/2,1/2,0),则原子3的坐标分别为________________。

【答案】![]() 12 NA BCD
12 NA BCD ![]() anm
anm ![]() (1/4,3/4,3/4)
(1/4,3/4,3/4)
【解析】
(1)![]() 中碳氮之间为叁键,电子式为
中碳氮之间为叁键,电子式为![]() ,共价三键由一个σ键,两个π键组成,故1个
,共价三键由一个σ键,两个π键组成,故1个![]() 中含有1个σ键,
中含有1个σ键,![]() 中的配位键也是σ键,共6个配位键,故1 mol
中的配位键也是σ键,共6个配位键,故1 mol![]() 中含σ键数目为
中含σ键数目为![]() ,
,![]() 中
中![]() 中存在共价键,
中存在共价键, ![]() 与亚铁离子之间络合存在配位键,钾离子与
与亚铁离子之间络合存在配位键,钾离子与![]() 之间存在离子键,故选BCD;
之间存在离子键,故选BCD;
答案为: ![]() ;
;![]() ;BCD
;BCD
(2)硼原子和磷原子的最近距离为晶胞的体对角线的![]() ,即
,即![]() nm,根据均摊原则,每个晶胞含有4个硼原子,4个磷原子,
nm,根据均摊原则,每个晶胞含有4个硼原子,4个磷原子,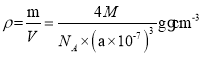 ,
,
故答案为:![]() nm;
nm;![]() ;
;
(3)将该晶胞切成8等份,即8个小立方体,原子3位于左上方立方体的体心,根据原子1的坐标为(1/2,1/2,0),故原子3的坐标为(1/4,3/4,3/4);
故答案为:(1/4,3/4,3/4)。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】分析如图装置,回答问题:
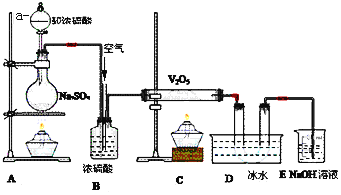
(1)写出下列仪器的名称:a_____
(2)装置A的烧瓶中发生的反应的化学方程式为_____
(3)装置C的直玻管中发生的反应的化学方程式为_____,
(4)在装置D的U形管中有无色晶体生成,此晶体的化学式是_____,
(5)装置E中NaOH的作用是_____,反应的离子方程式为_____;
(6)B装置的作用很多,除了可以混匀气体外,还可以:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )

A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是( )

A.图甲证明非金属性强弱:S>C>Si
B.装置乙可用于检验有乙烯生成
C.图丙构成铜锌原电池,产生持续稳定的电流
D.图丁可制备并收集NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学的应用十分广泛,是现代生产、生活、国防,乃至整个人类生活不可缺的物质条件。请根据所给材料回答下列问题:
(1)请结合组成原电池的条件,将氧化还原反应:2Fe3++Cu=2Fe2++Cu2+设计成一个原电池。
①电解液:___,
②正极材料:___;
③负极反应式:___。
(2)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)+MH![]() Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为___。
②当该电池充电时,与外电源正极连接的电极上发生的反应是___。
A.H2O的还原 B.NiO(OH)的还原 C.H2的氧化 D.Ni(OH)2的氧化
(3)按如图电解饱和食盐水溶液,写出该电解池中发生反应的总反应式:___;将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
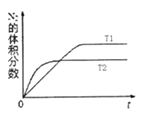
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。
(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:
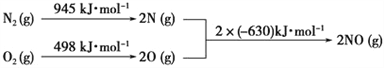
写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
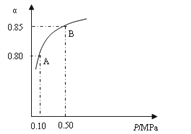
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给下列有机物命名及写结构简式。
(1)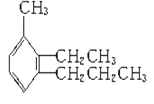 ____________________________________
____________________________________
(2)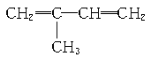 ____________________________________
____________________________________
(3)间甲基苯乙烯:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
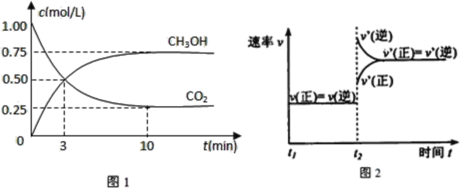
①从反应开始到平衡,氢气的平均反应速率v(H2)=__;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是__热(填“吸”或“放”)反应。
③该反应的平衡常数K为__(保留两位小数)。若提高温度到800℃进行,达平衡时,K值__(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为__。
Ⅱ.(2)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8kJmol-1
CH3OH(g) △H=-90.8kJmol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJmol-1
CO2(g)+H2(g) △H=-41.3kJmol-1
总合成反应的热化学方程式为__。
(3)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__(填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL-1 | 0.44 | 0.60 | 0.60 |
此时,v(正)__v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com