
| A. | pH=5的 H2S溶液中,c(H+)=c(HS-)=1×10-5mol/L | |
| B. | 稀释氨水溶液10倍后,其c(OH-)为原來的$\frac{1}{10}$ | |
| C. | pH之和为14的 H2C2O4与NaOH 溶液混合:c(Na+)+c(H+)=c(OH-)+C(HC2O4-) | |
| D. | 将等物质的费的Na2CO3和NaHCO3混合溶于水中:$\frac{c(C{O}_{{3}^{2-}})}{c(HC{O}_{{3}^{-}})}$<1 |
分析 A.根据硫化氢溶液中的电离平衡H2S?H++HS-、HS-?H++S2-、H2O?H++OH-判断;
B.一水合氨为弱碱,弱碱在稀释过程中溶液中的氢氧根离子浓度变化比强碱溶液小;
C.pH之和为14的 H2C2O4与NaOH 溶液混合溶液中存在电荷守恒;
D.将等物质的量的Na2CO3和NaHCO3混合溶于水中,碳酸根离子水解程度大于碳酸氢根离子.
解答 解:A.H2S溶液中存在电离平衡:H2S?H++HS-、HS-?H++S2-、H2O?H++OH-,根据上述反应知,氢离子来自水的电离和硫化氢的电离,则pH=5的H2S溶液中,c(H+)=1×10-5 mol•L-1>c(HS-),故A错误;
B.一水合氨为弱电解质,加水稀释后促进了其电离,溶液中的氢氧根离子浓度变化比强碱溶液小,其c(OH-)比原來的$\frac{1}{10}$大,故B错误;
C.pH之和为14的 H2C2O4与NaOH 溶液混合,溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故C错误;
D.碳酸根离子水解程度大于碳酸氢根离子,将等物质的量的Na2CO3和NaHCO3混合溶于水中$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$<1,故D正确;
故选D.
点评 题考查了溶液中离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意掌握盐的水解原理及其应用方法,要求学生能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小.


科目:高中化学 来源: 题型:选择题
| A. | NaOH的电子式: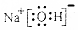 | B. | 硫离子的结构示意图: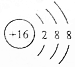 | ||
| C. | 次氯酸钠分子式:NaClO | D. | Na2O2中过氧离子的化学式:O22- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁在足量氧气中燃烧,转移的电子数为2NA | |
| B. | 1g氢气含有NA个氢气分子 | |
| C. | 标准状况下,22.4 L水含有1 mol水分子 | |
| D. | 2 mol钠与过量稀盐酸反应生成NA个氢气分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 0.1molAgCl和0.1molAgl混合后加入1 L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| B. | 氮元素的非金属性强于磷,氮气活泼性也强于磷 | |
| C. | 农村用明矾净化水,是利用其中Al (OH) 3胶体的吸附性 | |
| D. | NH4F溶液不能存放于玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cu2+ | |
| B. | pH=l的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学危险品易危害人类,应禁止生产 | |
| B. | 汽车尾气是目前城市大气污染产生的一个重要来源 | |
| C. | 氢氧化钠和氢氧化铝都可用于治疗胃酸过多 | |
| D. | 漂白粉长期放置在空气中不会变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
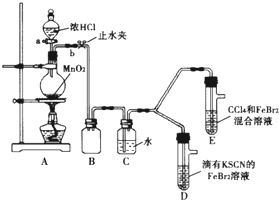 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、OH-、NO3-、HCO3- | ||
| C. | OH-、Ba2+、Na+、AlO2- | D. | Fe3+、NH4+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com