
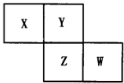
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | Z的单质与氢气反应较Y剧烈 | |
| B. | X、Y形成的化合物都易溶于水 | |
| C. | 这四种元素的单质以Z熔点最高 | |
| D. | 最高价氧化物对应水化物的酸性W比Z弱 |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.
A.同主族元素从上到下非金属性减弱,则非金属性Y>Z,非金属性越强,单质与氢气反应越剧烈,所以Y的单质与氢气反应较Z剧烈,故A错误;
B.X与Y形成的化合物中NO不溶于水,故B错误;
C.四种单质中常温下硫为固体,其它均为气体,故硫的熔点最高,故C正确;
D.非金属性S<Cl,故最高价含氧酸的酸性:硫酸<高氯酸,故D错误.
故选:C.
点评 本题考查位置结构性质关系应用,Y是推断的突破口,熟练掌握元素周期表结构及核外电子排布规律,理解掌握元素周期律.


科目:高中化学 来源: 题型:选择题
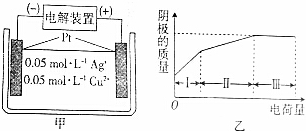
| A. | 区间Ⅰ,在阴极上有金属银析出 | |
| B. | 区间Ⅰ、Ⅱ、Ⅲ中溶液的pH均降低 | |
| C. | 区间Ⅱ,在阳极上有氧气放出 | |
| D. | 区间Ⅱ析出的固体质量是区间Ⅰ的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
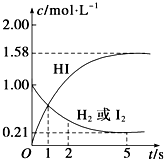 某温度时,向某V L的密闭容器中充入3mol
某温度时,向某V L的密闭容器中充入3mol查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量 | |
| B. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| C. | 工业上用离子交换膜法电解饱和食盐水制烧碱 | |
| D. | 工业上采用电解(省电能30%)的AlCl3-KCl熔融体的方法制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
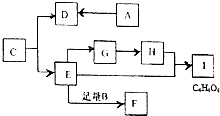 有机物A、B、C均由C、H、0三种元素组成,且均满足$\frac{m(C)+m(H)}{m(O)}$=$\frac{7}{8}$,其相对分子质量A<B<C<100,A~I均为有机物,它们之间存在如图所示的转化关系,下列说法正确的是( )
有机物A、B、C均由C、H、0三种元素组成,且均满足$\frac{m(C)+m(H)}{m(O)}$=$\frac{7}{8}$,其相对分子质量A<B<C<100,A~I均为有机物,它们之间存在如图所示的转化关系,下列说法正确的是( )| A. | 有机物A和E含有相同的官能团 | |
| B. | H加入足量澄清石灰水中,能使澄清石灰水变浑浊 | |
| C. | 有机物F的系统命名为乙二酸乙二酯 | |
| D. | 某芳香烃的相对分子质量为B的2倍,其一氯代物有两种,则该烃二氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
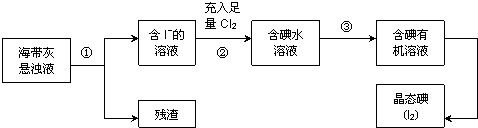
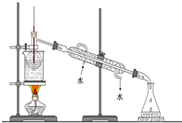
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
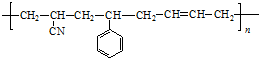 除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.
除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.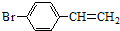 )需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.
)需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.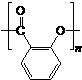 .
.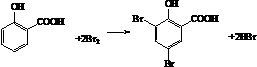 .
.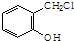 制备A的合成路线
制备A的合成路线查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com