
 Al(OH)3+ 3H+ Al2O3 Al2(SO4)3
Al(OH)3+ 3H+ Al2O3 Al2(SO4)3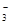 + H2O
+ H2O H2CO3 + OH— 2OH— +SiO2 = SiO2
H2CO3 + OH— 2OH— +SiO2 = SiO2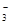 + H2O
+ H2O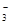 + Al3+= Al(OH)3↓+ 3CO2↑
+ Al3+= Al(OH)3↓+ 3CO2↑  Al(OH)3+ 3H+;由于水解是吸热的,所以升高温度,促进水解,且氯化氢极易挥发,所以最终得到的是氢氧化铝,灼烧得到氧化铝。由于硫酸是难挥发性的,所以将硫酸铝溶液蒸干,得到的是Al2(SO4)3。
Al(OH)3+ 3H+;由于水解是吸热的,所以升高温度,促进水解,且氯化氢极易挥发,所以最终得到的是氢氧化铝,灼烧得到氧化铝。由于硫酸是难挥发性的,所以将硫酸铝溶液蒸干,得到的是Al2(SO4)3。 H2CO3+OH-、2OH-+SiO2=SiO32-+H2O。
H2CO3+OH-、2OH-+SiO2=SiO32-+H2O。

科目:高中化学 来源:不详 题型:单选题
| A.X 〉Z 〉Y 〉M | B.X 〉Y 〉Z 〉M |
| C.M 〉Z 〉X 〉Y | D.X 〉Z 〉M 〉Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| B.纯铁比生铁的耐腐蚀性强 |
| C.铝是比较活泼金属,不能用铝制容器盛放冷的浓硫酸 |
| D.将铜放入稀硫酸中不溶解,再加入一些硝酸钾溶液铜就可溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三者对应的氧化物均能溶于水 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对热稳定性:Na2CO3 >NaHCO3 | B.常温时水溶性:Na2CO3 >NaHCO3 |
| C.与稀盐酸反应的快慢:Na2CO3 >NaHCO3 | D.相对分子质量:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2NaCl(熔融) 2Na+Cl2 2Na+Cl2 | B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe3O4+4CO  3Fe+4CO2 3Fe+4CO2 | D.2HgO  2Hg+O2 2Hg+O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

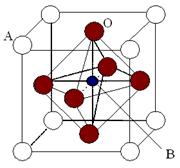
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com