
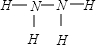 ,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.
,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.分析 (1)肼中相当于氨气分子中一个氢原子被氨基取代;写出反应方程式,注明物质的聚集状态,依据反应物用量与反应放出热量写出热化学方程式.
(2)找到NaH2PO2溶液中的阴阳离子,根据电荷守恒:阳离子带的正电荷总数=阴离子带的负电荷总数;根据转移电子守恒判断氧化产物,该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4:1,根据转移电子相等知,1molH3PO2失去4mol电子,所以P元素为+5价.
解答 解:(1)肼中相当于氨气分子中一个氢原子被氨基取代,所以肼的结构式为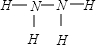 ;卫星发射时可用肼(N2H4)做燃料,1mol N2H4(l)在氧气(g)中燃烧,生成氮气(g)和水(l),放出622KJ热量,反应的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622 kJ/mol;
;卫星发射时可用肼(N2H4)做燃料,1mol N2H4(l)在氧气(g)中燃烧,生成氮气(g)和水(l),放出622KJ热量,反应的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622 kJ/mol;
故答案为: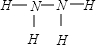 ;N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol
;N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol
(2)H3PO2是一元中强酸,则NaH2PO2为正盐,溶液中的离子有Na+、H+、H2PO2-、OH-,根据电荷守恒,阳离子带的正电荷总数与阴离子带的负电荷总数相等可得:C(Na+)+C(H+)═C(H2PO2-)+C(OH-);
根据化合物中化合价的代数和为0,确定H3PO2中P元素化合价,O元素为-2价、H元素为+1价,所以P元素为+1价,该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4:1,根据转移电子相等知,1molH3PO2失去4mol电子,所以P元素为+5价,则氧化产物是H3PO4,还原产物为单质银,再根据电荷守恒和元素原子守恒可得:H3PO2+4Ag++2H2O═H3PO4+4Ag+4H+.
故答案为:C(Na+)+C(H+)═C(H2PO2-)+C(OH-);
H3PO2+4Ag++2H2O═H3PO4+4Ag+4H+
点评 本题考查了物质结构式的书写、热化学方程式、三大守恒中的电荷守恒和氧化还原反应,明确物质的性质的关键,利用氧化还原反应的规律即可写出方程式,题目难度中等.


科目:高中化学 来源: 题型:解答题
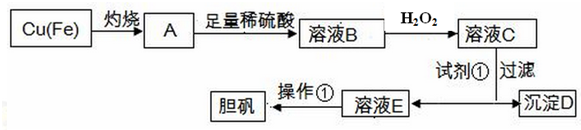
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
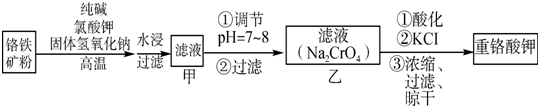
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
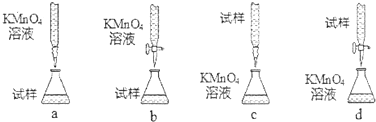
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
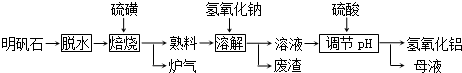
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
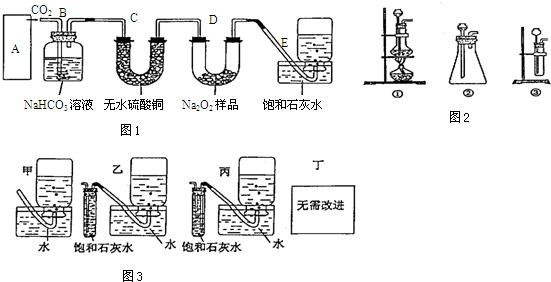
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+
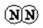 $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com