
(1)各周期的元素种数存在差别的原因是什么?
(2)相邻周期起始元素原子序数差等于;相邻周期结束元素原子序数差等于____________;根据上述关系和各周期的元素种数推出各周期起始元素、结束元素的原子序数分别是______________、______________。
(3)第7周期如果排完,其元素种类可能是___________,结束元素的原子序数可能是__________;第8周期的起始元素和结束元素的原子序数可能是___________和___________。
(4)利用上述得出的规律来推测56号、33号元素的位置。
(5)每周期中非金属元素种类与周期序数间的关系是怎样的?可能还有几种非金属元素还未发现?
(6)同周期中ⅡA族和ⅢA族元素原子序数差可能是多少?
解析:本题中有关元素周期表的结构知识建构过程的题目,要求自己寻找材料,分析其中的数据,总结归纳周期表中潜藏的一些规律,并尽可能地挖掘出产生这些规律的原因。
(1)第1周期比较特殊,只有2种元素,分布在ⅠA族和0族;第2、3周期相同,分别有8种元素,分布在7个主族和0族;4、5周期相同,比第2、3周期多10个纵行的过渡元素(即7个副族和1个Ⅷ族),所以分别有18种元素;第6周期ⅢB族为镧系元素,一个格内有15种元素,较原来多14种,共有32种元素;所以1和2周期、3和4周期、5和6周期元素种数差分别是6、10、14。
(2)相邻周期起始元素原子序数差等于上一周期的元素种数;相邻周期结束元素原子序数差等于下一周期的元素种数;根据上述关系和各周期的元素种数可以推出各周期起始元素、结束元素的原子序数分别是:1,3(=1+2),11(=3+8),19(=11+8),37(=19+18),55(=37+18),87(=55+32);2,10(=2+8),18(=10+8),36(=18+18),54(=36+18),86(=54+32)。
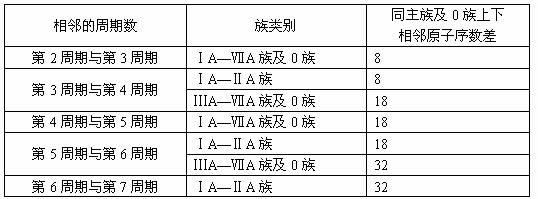
对主族元素电子层结构的差异和周期表中每周期含有元素的种类必须熟练掌握,并灵活组合。同主族上下相邻元素原子序数差的情况汇总如下:
第1周期与第2周期H与Li间原子序数差为2,He与Ne间原子序数差为8,其他情况见下表:
(3)已知周期的元素种数依次为:2、8、18、32,假设数据的序数为n,利用数学归纳法可以得出an=2n2,所以,n=5时,an=50,n=6,7…时,an=72,98…
第7周期还未排完,类似于第6周期的镧系元素,本周期ⅢB族也有含有15种元素的锕系元素,所以本周期如果排满,也应有32种元素。结束元素的原子序数可能是86+32=118;第8周期起始元素的原子序数可能是87+32=119;要判断结束元素的原子序数,首先必须要判断出第8周期的元素种数为50,第8周期的结束元素的原子序数可能是118+50=168。
(4)首先根据每一周期的元素种数确定起始元素、结束元素的原子序数,列表如下:
1………………2种………………2
3………………8种………………10
11………………8种………………18
19………………18种………………36
37………………18种………………54
55………………32种………………86
87………………32种………………118
再根据未知元素的原子序数所在的范围确定周期序数,56号、33号元素分别在55—86、19—36,所以分别处于第6周期和第4周期,56号元素靠近左侧,因为55号元素是ⅠA族,所以56号元素应该是ⅡA族;33号元素靠近右侧,因为36号元素是0族,所以35号、34号、33号元素应该依次是ⅦA族、ⅥA族、ⅤA族。所以56号、33号元素的位置分别是第6周期ⅡA族和第4周期ⅤA族。
(5)可以利用归纳总结的方法进行判断:
![]()
除第1周期外,第2—6周期的周期序数和非金属元素种数之和等于8,所以,除第1周期外,随着周期序数的递增,非金属元素的种数(为8-n,n是周期序数)是逐渐递减的,按此规律推测得:第7周期还有一种非金属元素,第8周期就没有非金属元素了。所以在未发现的元素中可能就只有一种非金属元素了。
(6)根据(1)题答案的有关信息,可以得出如下结论:
答案:见解析


科目:高中化学 来源: 题型:阅读理解
阅读分析材料,据此完成下列要求
短周期元素A、B、C、D、E、F,它们的原子序数依次增大,其中B和C为同一周期;D、E、F为同一周期;A和D、C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2、X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(9分)阅读分析材料,据此完成下列要求:
短周期元素A.B.C.D.E.F,它们的原子序数依次增大,其中B和C为同一周期;D.E.F为同一周期;A和D.C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2.X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖南嘉禾一中高三1月份高考押题化学试卷 题型:填空题
(9分)阅读分析材料,据此完成下列要求:
短周期元素A.B.C.D.E.F,它们的原子序数依次增大,其中B和C为同一周期;D.E.F为同一周期;A和D.C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2.X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读分析材料,据此完成下列要求:
短周期元素A.B.C.D.E.F,它们的原子序数依次增大,其中B和C为同一周期;D.E.F为同一周期;A和D.C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2.X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某主族元素X的原子核内质子数等于中子数,在含该金属阳离子X2+的溶液中,X2+的浓度为0.8mol/L,且10mL这种溶液含该金属阳离子0.192g。若由碳棒、该金属和200mL 稀硫酸组成的原电池中,碳棒上共析出0.15mol气体。根据计算推断:
⑴.X是什么元素及在元素周期表中的位置?
⑵.在原电池中溶解的该金属的质量是多少?
⑶.计算在原电池中转移的电子的物质的量。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com