
| A. | 容量瓶、分液漏斗、滴定管在使用府前都需要检杏是否漏水,可以用相同的方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的1/2 | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体一半透膜法分离提纯;悬浊液一过滤分离,本质上就是依椐所分离粒子的直径大小选择具有合适孔径的“筛子” |
分析 A.根据带有旋塞和瓶塞的仪器,一般在使用前需要检查是否漏水;
B.蒸发时,加入的液体不能超过容器容积的$\frac{2}{3}$;
C.酚酞:酸滴定碱时:颜色由红刚好褪色;甲基橙:酸滴定碱时:颜色由黄到橙色;
D.渗析、过滤都利用微粒直径大小.
解答 解:A.容量瓶、分液漏斗、滴定管是带有旋塞和瓶塞的仪器,使用前需要检查是否漏水,故A正确;
B.蒸发时,加入的液体不能超过容器容积的$\frac{2}{3}$,过多液体可能溢出,故B错误;
C.酚酞:酸滴定碱时:颜色由红刚好褪色,甲基橙:酸滴定碱时:颜色由黄到橙色,红色退去颜色更明显,故C正确;
D.胶体粒子直径比半透膜小,可用渗析方法分离,浊液粒子不能透过滤纸,可用过滤的方法分离,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的分离、中和滴定实验等知识,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意相关基础知识的积累,难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 同物质的量的物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa、25℃时,H2的燃烧热为△H=-285.8KJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的溶液 | B. | 能与金属Al反应放出H2的溶液 | ||
| C. | 遇酚酞显无色的溶液 | D. | c(H+)>c(OH-)的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 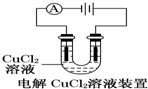 装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝 | |
| B. | 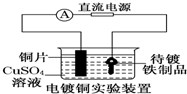 装置中待镀铁制品应与电源正极相连 | |
| C. | 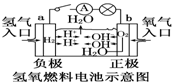 装置中电子由b极流向a极 | |
| D. | 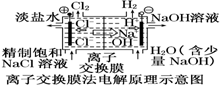 装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com