
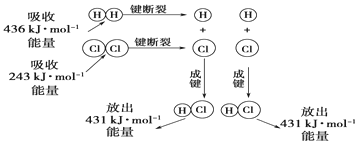
分析 (1)①反应物断键吸收的总能量为1molH2和1molCl2的键能和;
②生成物成键放出的总能量为2molHCl的总键能;
③根据反应热=反应物的键能总和减生成物的键能总判断;
④△H<0,为放热反应,反应物的总能量>生成物的总能量,△H>0,为吸热反应,反应物的总能量<生成物的总能量;
(2)①最外层电子数相同的元素不一定为同一族,如氦与镁等;
②熟记稀有气体也就是0族元素的质子数(或碱金属族元素的质子数),这些元素分别是每个周期最后(或开始)一种元素,He-2,Ne-10,Ar-18,Kr-36,Xe-54,Rn-86,第七周期稀有气体原子序数=86+32=118,再根据原子序数之间的差值确定;
③元素的非金属性越强,对应的最高价氧化物水化物酸性越强;
④全部由非金属元素组成的化合物可能是离子化合物,可能是共价化合物;
⑤键能是指断开1mol共价键吸收的能量或形成1mol共价键放出的能量,吸收和放出的能量相等.
解答 解:(1)①反应物断键吸收的总能量为1molH2和1molCl2的键能和,则反应物断键吸收的总能量为436kJ+243kJ=679kJ,
故答案为:吸收;679kJ;
②生成物成键释放的总能量为2molHCl的总键能,则生成物成键放出的总能量为431kJ×2=862kJ,
故答案为:释放;862kJ;
③反应热=反应物的键能总和减生成物的键能总和=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,△H<0,所以该反应为放热反应,
故答案为:放出;
④由③可知△H<0,该反应为放热反应,所以反应物的总能量>生成物的总能量,故答案为:>;
(2)①最外层电子数相同的元素不一定是同族元素,氦与镁最外层电子数都为2,所处族不同,故①错误;
②第七周期稀有气体原子序数=86+32=118,是第七周期最后一种元素,位于18列,116号元素处于第16列,故该元素位于第七周期第ⅥA族,故②正确;
③元素的最高价氧化物的水化物的酸性越强,则其非金属性越强,故③正确;
④全部由非金属元素组成的化合物可能是离子化合物,可能是共价化合物,如铵盐是离子化合物、硝酸是共价化合物,故④错误;
⑤相同条件下由原子形成1 mol H-Cl 键所放出的能量与断开1 mol H-Cl 键吸收的能量相等,故⑤正确;
故答案为:×;√;√;×;√.
点评 本题主要考查了化学反应与能量的变化以及位置结构性质的相互关系及应用,为高考常见题型,侧重于学生的分析能力的考查,根据键能判断△H,注意把握元素的性质与元素周期表的关系,难度不大.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: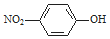 | D. | H2S的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=4的HCOOH溶液和pH=10的氨水等体积混合;pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定不相等 | |
| C. | 常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 常温下0.lmol/L pH为4的NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 钢闸门容易被腐蚀 | a、b均为惰性电极,b极反应是:O+4OH--4e-=2H2O | 阴、阳两极生成的气体的物质的量之比是1:1 | 电池工作一段时间 后,乙池溶液的总质量增加 |
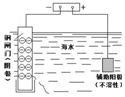 | 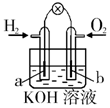 | 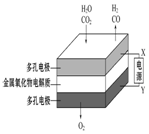 | 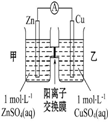 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )和抗癫痫药物
)和抗癫痫药物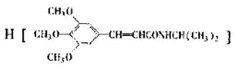 的路线如下(部分反应条件和试剂略去)
的路线如下(部分反应条件和试剂略去)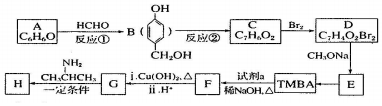
 +H2O(R、R′表示烃基或氢原子)
+H2O(R、R′表示烃基或氢原子)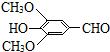 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→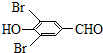 +2HBr.
+2HBr.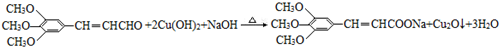 .
.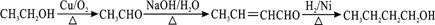 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 土壤胶体带负电荷,有利于铵态氮肥的吸收 | |
| B. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com