

分析 (1)溶液C通过调节pH可以使Fe3+沉淀完全,加入的物质能消耗氢离子,但是不能引入新的杂质;
(2)根据Ksp[Fe(OH)3]和溶液中氢氧根离子的浓度计算c(Fe3+);Qc与Ksp[Cu(OH)2]的相对大小判断;
(3)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,根据物质的量关系写方程式.
解答 解:(1)溶液C通过调节pH可以使Fe3+沉淀完全,应加入CuO、碱式碳酸铜或氢氧化铜,而加入铜粉生成Fe2+,加入氨水引入新的杂质,
故答案为:CD;
(2)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=1.0×10-39=c(Fe3+)×c3(OH-),所以c(Fe3+)=$\frac{1.0×1{0}^{-39}}{({1×1{0}^{-10})}^{3}}$mol/L=1.0×10-9mol/L;
已知溶液中氢氧根离子的浓度为10-10mol/L,则Qc=c(Cu2+)×c2(OH-)=1×(10-10)2=10-20<Ksp[Cu(OH)2]=2.2×10-20,所以没有氢氧化铜沉淀生成,
故答案:1.0×10-9mol/L;无;
(3)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,则反应时铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,其离子方程式为:2Al3++3SO42-+3Ba2++7OH-═AlO2-+Al(OH)3↓+3BaSO4↓+2H2O;
故答案为:2Al3++3SO42-+3Ba2++7OH-═AlO2-+Al(OH)3↓+3BaSO4↓+2H2O.
点评 本题考查了物质分离与提纯方法的综合应用,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小;则在卤素单质中碘的熔点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低了反应的活化能 | B. | 增大了反应物、生成物的能量 | ||
| C. | 降低了反应的焓变 | D. | 增大了反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变性蛋白质不能食用 | |
| B. | 可用甲醛浸泡海鲜 | |
| C. | SO2可以用来增白食品 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| C. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| D. | 为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | Z、Q均为ⅣA族元素 | |
| B. | X、Y、M三种元素中金属性最强的是M | |
| C. | R、Z形成的R2Z分子是非极性分子 | |
| D. | M的氢氧化物和Y的氢氧化物都能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
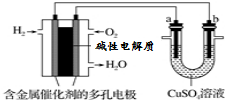
| A. | 此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 | |
| B. | 若a为纯铜,b为粗铜,该装置可用于粗铜的电解精炼 | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O=4OH- | |
| D. | 电子经导线流入b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
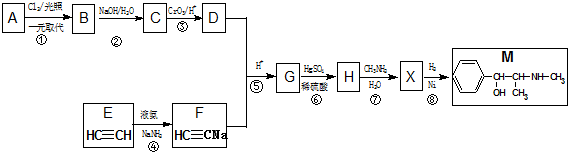
 ≡C-R′
≡C-R′

 .
. +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$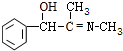 +H2O.
+H2O. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com