
能源问题是人类社会面临的重大课题,甲
醇是一种可再生能源,具有开发和应用的广阔前景,研究
 甲醇具有重要意义。
甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验 测得甲醇的物质的量和温度、时间的关系曲线如右图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:
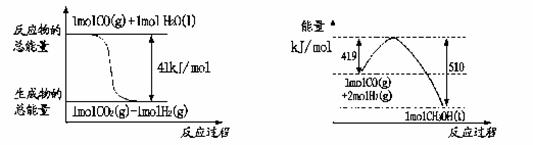
由二氧化碳和氢气制备甲醇的热化学方程式为_______。
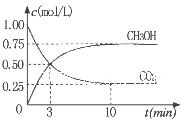 ②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
和CH3OH(g)的浓度随时间变化如右图所示。从反应开始到
平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。
能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
 ①甲醇蒸汽重整法。主要反应为;CH3OH(g)
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
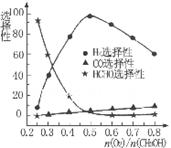
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催
化剂时原料气比例对反应的选择性(选择性越大,表示生成的该
物质越多)影响关系如右图所示。则当n(O2)/n(CH3OH) =0.25
时。CH3OH与O2发生的主要反应方程式为______ 。在制备
H2:时最好控制n(O2))/n(CH3OH)=______。
 n(CH3OH)/n(CO2)增大。另外比如加压、增加H2的量或将水蒸气从混合物中分离出来等措施也能使平衡体系中n(CH3OH)/n(CO2))增大。(3)反应开始时n(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.假设反应过程中CH3OH改变的物质的量为X,则达到平衡时各物质的物质的量为n(CH3OH)= (0.6-X)mol, n(CO) =Xmol n(H2)=2Xmol,对于体积固定的密闭容器中的气体反应来说,反应前后的压强比等于它们的物质的量的比。所以(0.6+2X)÷0.6=2.2,解得X=0.36.所以CH3OH的平衡转化率为0.36÷0.6×100﹪=60﹪。②由图可知当n(O2)/n(CH3OH) =0.25时得到的产物是甲醛,CH3OH与O2发生的主要反应方程式为2CH3OH + O2
n(CH3OH)/n(CO2)增大。另外比如加压、增加H2的量或将水蒸气从混合物中分离出来等措施也能使平衡体系中n(CH3OH)/n(CO2))增大。(3)反应开始时n(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.假设反应过程中CH3OH改变的物质的量为X,则达到平衡时各物质的物质的量为n(CH3OH)= (0.6-X)mol, n(CO) =Xmol n(H2)=2Xmol,对于体积固定的密闭容器中的气体反应来说,反应前后的压强比等于它们的物质的量的比。所以(0.6+2X)÷0.6=2.2,解得X=0.36.所以CH3OH的平衡转化率为0.36÷0.6×100﹪=60﹪。②由图可知当n(O2)/n(CH3OH) =0.25时得到的产物是甲醛,CH3OH与O2发生的主要反应方程式为2CH3OH + O2  2HCHO+ 2H2O。在制备H2时由于在n(O2)/n(CH3OH) =0.5时选择性最高,所以最好控制n(O2))/n(CH3OH)= 0.5。
2HCHO+ 2H2O。在制备H2时由于在n(O2)/n(CH3OH) =0.5时选择性最高,所以最好控制n(O2))/n(CH3OH)= 0.5。
考点:考查关于甲醇燃料电池的化学反应原理及制法等知识。


科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A.工业电解饱和食盐水:2Cl-+ H2O = Cl2↑+ H2↑+ OH-
B.碳酸钠的水解:CO32-+ 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
C.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-===AlO+2H2O
D.用过氧化氢从酸化海带灰浸出液中提取碘:2I-+ H2O2 +2H+ = I2 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑾ | ⑿ |
(1)写出下列元素的元素符号:① ② ⑾
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(4)在③与④的单质中,化学性质较活泼的是 ,判断依据是 ;在⑧与⑿的单质中,化学性质较为活泼的是 ,判断依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2,下解说法不正确的是
A.通入CH3OH的电极为负极
B.随着放电的进行,负极附近pH上升
C.每消耗1molCH3OH可以向外电路提供6mol e-
D.通入O2的一极电极反应为 4H2O+2O2-8e-=8OH-。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置正确且能达到目的的是
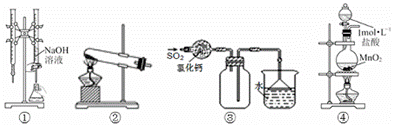
A.装置①可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验
B.装置②可用于氯化铵固体和氢氧化钙固体反应制取少量氨气
C.装置③可用于收集SO2,并吸收多余的SO2
D.装置④可用于制取少量Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.固体碘的升华 B.生右灰作为干燥剂吸水
C.氯化钠的熔化 D.酒精溶解于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释实验事实的平衡不正确的是
| 实 验 | 解释 | |
| A | 100℃ 0.1 mol/LNa2SO4溶液pH= 6.2 | H2O |
| B | 0.1 mol/L CH3COOH的pH=3 | CH3COOH |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3+ + 3OH- |
| D | 用稀硫酸洗涤BaSO4,沉淀损失小 | BaSO4(s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com