
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
解析 本题是用一种试剂鉴别多种物质的实验题,着重考查学生对常见物质的化学性质、物理性质的掌握情况,以及鉴别实验方案的设计能力的考查。A中可先利用FeCl3鉴别出Ba(OH)2[产生红褐色Fe(OH)3沉淀]和KSCN(溶液变为红色),然后再利用Ba(OH)2鉴别出Mg(NO3)2(产生白色沉淀),最后一种为NaCl,故能鉴别;B中可将H2SO4分别加入四种溶液中,产生无色无味气体的为NaHCO3,产生白色沉淀的为Na2SiO3,产生刺激性气味气体的为(NH4)2SO3,余下的为NaNO3,故能鉴别;C中用AgNO3溶液无法鉴别CaCl2溶液和K2CO3溶液;D中可将KOH溶液分别逐滴加入四种溶液中,产生蓝色沉淀的为CuSO4,先产生白色沉淀后又溶解的为AlCl3,加热有刺激性气味气体产生的为(NH4)3PO4,没有明显现象的是NaBr溶液,故选C。
答案 C


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法一定正确的是 ( )
A.周期表中同主族元素单质的熔点从上到下逐渐增高
B.16g石墨与8gCH4所含共价键数目相等
C.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
D.若将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到AlCl3和Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于甲烷、乙烯、乙醇、乙酸的说法中,不正确的是 ( )
A.乙烯可以使溴水褪色,发生加成反应
B.甲烷和氯气光照条件下反应,反应类型为取代反应
C.乙醇在铜做催化剂并加热条件下生成乙醛,发生还原反应
D.生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.原子最外层电子数大于3(小于8)的元素一定是非金属元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第2周期
D.某元素的离子的最外层与次外层电子数相同,该元素一定位于第3周期
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能 电离出电子数相等的阴、阳离子。A、C位于同一主族 ,A为非金属元素,B的最外层 电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
,A为非金属元素,B的最外层 电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为________________________ ______,
______,
其中含有的化学键类型为___ __________________________________________。
__________________________________________。
(2)由上述A、B、C、D四种 元素中的三种组
元素中的三种组 成某种盐,水溶液显碱性,是家用消毒剂 的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________________________________________________。
成某种盐,水溶液显碱性,是家用消毒剂 的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________________________________________________。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说 法正确的是________(填序 号)。
法正确的是________(填序 号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过 化合反应生成
化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如下图所示,完成下列填空:

(1)在电解过程中,与电源负极相连的电极上的电极反应式为_________________________________________________________________,
若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是_______________________________________________________________。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去,该钡试剂可以是________(选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2C O3
O3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是
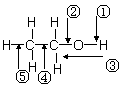 A.和金属钠作用时,键②断裂
A.和金属钠作用时,键②断裂
B.和浓硫酸共热至170 ℃时,键①和⑤断裂
C.和乙酸、浓硫酸共热时,键①断裂
D.在铜催化下和氧气反应时,键①和②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
喹硫平可用于精神疾病的治疗,其结构为:
( )2·
)2· ,它的合成路线如下:
,它的合成路线如下:

已知:(Ⅰ)反应①为取代反应;(Ⅱ)A的系统命名为1,4-二溴―2―丁烯。
请回答下列问题:
(1)反应①的产物
 中除硫醚键(-S-)外,还含有的官能团名称
中除硫醚键(-S-)外,还含有的官能团名称
为 ▲ , ▲ 。
(2)反应③的类型是 ▲ 反应,反应⑤的目的是 ▲ 。
(3)写出反应④的化学方程式 ▲ 。
(4)物质B的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有 ▲ 种。
(5)已知:-SH的性质与-OH相似。
物质 一定条件下形成聚合物的结构简式为 ▲ 。
一定条件下形成聚合物的结构简式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.在0.10 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO )
)
B.甲烷的标准燃烧热是890.3 kJ·mol-1,则甲烷燃烧的热化学方程式是:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O  2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.以KOH为电解质溶液的甲醇燃料电池的负极电极反应式:
CH3OH-6e-+H2O=CO2↑+6H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com