

分析 装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-,
(1)亚硫酸氢根离子的电离程度大于水解程度;
(2)NO被Ce4+氧化为NO3-时,氧化产物是硝酸根离子,还原产物是Ce3+,根据方程可得;
(3)装置III中阴极上的电极反应式为2HSO3-放电,据此书写;装置IV中NO2- 的反应为2NO2-+O2+2H++2NH3=2NH4++2NO3-,根据硝酸根的量计算氧气;
(4)验证硫酸根离子或者亚硫酸氢根离子即可证明氧化时一定有反应②发生;
(5)原电池中阳离子移向正极,依据二氧化硫、氧气发生反应判断电极,判断质子移动方向;二氧化硫在负极失去电子发生氧化反应.
解答 解:(1)HSO3-在溶液中存在电离平衡和水解平衡:HSO3-?SO32-+H+,HSO3-+H2O?H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的C(H+)>c(OH-),溶液呈酸性;
故答案为:HSO3-在溶液中存在电离平衡和水解平衡:HSO3-?SO32-+H+,HSO3-+H2O?H2SO3+OH-,由于HSO3-的电离程度大于水解程度,故溶液中的C(H+)>c(OH-),溶液呈酸性;
(2)装置II中酸性条件下,NO被Ce4+氧化为NO3-时,反应为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,氧化产物是硝酸根离子,还原产物是Ce3+,则氧化产物与还原产物的物质的量之比1:3;
故答案为:1:3;
(3)电解槽阴极发生还原反应,SO32-被还原为S2O42-,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O;若装置IV中NO2- 的浓度为11.5g•L-1,则n(NO2- )=$\frac{11.5g/L×1L}{46g/mol}$=0.25mol,要使1dm3该溶液中的NO2- 完全转化为NH4NO3,根据反应2NO2-+O2+2H++2NH3=2NH4++2NO3-,至少向装置IV中通入标准状况下的O2$\frac{1}{2}×0.25mol×22.4L/mol$=2.8L;
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;2.8;
(4)实验②为Na2S2O4+O2+H2O═NaHSO3+NaHSO4,要证明该反应的发生,可验证其溶液中的硫酸根离子和亚硫酸氢根离子,方法为:取少量固体溶于水中,加人BaCl2溶液,有白色沉淀产生,则证明是②(或取少量固体溶于水中,若闻到刺激性气味);
故答案为:取少量固体溶于水中,加人BaCl2溶液,有白色沉淀产生,则证明是②(或取少量固体溶于水中,若闻到刺激性气味);
(5)二氧化硫发生氧化反应,氧气发生还原反应,所以二氧化硫所在电极为负极,氧气所在电极为正极,原电池中阳离子移向正极,所以质子移动方向为:从A到B;二氧化硫在负极失去电子发生氧化反应,电极反应式为:SO2-2e-+2H2O═SO42-+4H+;
故答案为:从A到B;SO2-2e-+2H2O═SO42-+4H+.
点评 本题考查电工业生产中化学原理吸收SO2和NO的工艺,为高频考点,侧重分析、计算能力的考查,题目涉及氧化还原反应、电化学等,综合性强,题目难度较大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的H+的浓度是1.0×10-10 mol/L | |
| B. | 该温度高于25°C | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、醋、糖都有防腐功效 | |
| B. | 煤粉碎后更易燃烧,是因为粉碎增强了煤的还原性 | |
| C. | 鸡蛋煮熟后,蛋白质水解成了氨基酸 | |
| D. | 月饼包装中的还原铁粉小包和旺旺仙贝包装中的生石灰小包的作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
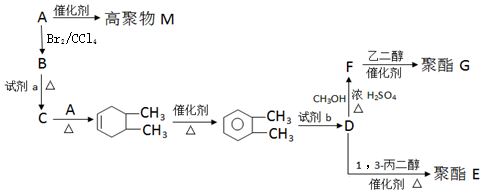
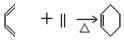
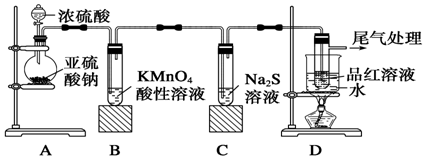
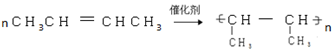 ②B→C
②B→C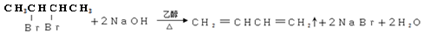
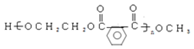 .
. 以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物LiAl具有强还原性,作负极材料 | |
| B. | 为了延长电池的使用寿命,可以隔一段时间添加含电解质的水溶液 | |
| C. | 放电时,该电池的总反应式为2Li+FeS═Li2S+Fe | |
| D. | 放电时,当电路中0.1mol电子的电量时,有0.1molLi+向LiAl移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3、NH4HCO3 | B. | KNO3、Na2CO3 | C. | HNO3、(NH4)2CO3 | D. | NH4NO3、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20个电子的氯原子的符号为:3517Cl | |
| B. | 四氯化碳的球棍模型: | |
| C. | 氩的原子结构示意图: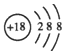 | |
| D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com