

| A、不是同分异构体 |
| B、均是芳香族化合物 |
| C、均能与溴水反应 |
| D、可用红外光谱区分,但不能用核磁共振氢谱区分 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、Cl2是氧化产物,KCl是还原产物 |
| B、盐酸在该反应中只表现还原性 |
| C、每生成3 mol Cl2,有1 mol KClO3发生氧化反应 |
| D、每转移0.1 mol电子,能生成标准状况1344mLCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
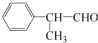 ,以苯为原料工业合成路线如下:
,以苯为原料工业合成路线如下:
 (R-代表烃基)
(R-代表烃基)| H2O2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到紫色石蕊试纸上 | 试纸先变红后褪色 | 浓硫酸有酸性和漂白性 |
| B | 用一定浓度KMnO4溶液滴定淀粉KI 溶液 | 溶液出现蓝色 | 达到滴定终点 |
| C | 将I2 和NH4Cl的固体混合物放入烧杯中,上口放置盛有冷水的园地烧瓶,加热 | 烧瓶底部出现紫黑色的固体 | 可用加热法将I2和NH4Cl的固体混合物分离 |
| D | 灼烧蚕丝 | 产生烧焦羽毛的气味 | 蚕丝的主要成分为蛋白质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
2- 4 |
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况下) |
| 3 | 加入足量BaCl2溶液,反应后进行、干燥、称量,再向沉淀中加足量稀盐酸、然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数2.33g |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
| 1 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷、乙醇都能与钠反应生成氢气 |
| B、用过滤的方法可以分离乙酸乙酯和乙酸 |
| C、75%(体积分数)的乙醇溶液常用于医疗消毒 |
| D、在一定条件下,乙烯可以与氢气发生加成反应,苯则不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com