
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀。
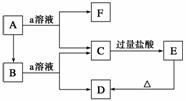
请回答下列问题:
(1)B的化学式是____________,目前B已被用作________的主要原料。
(2)B和a溶液反应的离子方程式是_______________________________________。
(3)A和a溶液反应的离子方程式是_______________________________________。
(4)C和过量的盐酸反应的离子方程式是___________________________________。
审题分析 本题应抓住框图中的转化关系,以题设条件C+过量盐酸―→E(白色沉淀)为
突破口进行推断,并结合已有知识进行设定与推测。
答案 (1)SiO2 光导纤维
(2)SiO2+2OH-===SiO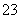 +H2O
+H2O
(3)Si+2OH-+H2O===SiO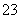 +2H2↑
+2H2↑
(4)SiO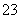 +2H+===H2SiO3↓
+2H+===H2SiO3↓
解析 C与过量的盐酸反应生成白色沉淀E,则E可能是硅酸或氯化银,若E是氯化银,则C是硝酸银,A为银,则根据已有知识,银可以与硝酸反应生成硝酸银,而银与硝酸反应能生成三种产物,不符合框图中物质间的转化关系。则E 只能为硅酸,则C为硅酸盐,A为硅,a溶液为强碱的水溶液,进一步推出B为二氧化硅。
只能为硅酸,则C为硅酸盐,A为硅,a溶液为强碱的水溶液,进一步推出B为二氧化硅。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
 下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
A.4KI+O2+2H2O=4KOH+2I2
B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca
C.I2+2NaClO3=2NaIO3+Cl2
D.MnO2+4HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体.D的俗名叫铁红,A是形成酸雨的主要气体。则:
(1)在周期表中,组成单质I的元素位于第 周期 族;
(2)写出S2-的离子结构示意图: ;写出N2的结构式: ;
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应是 ;(填写序号)
(4)反应④的离子方程式是: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
一种核素W的质量数为28,中子数为14,则W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是 ( )
A.石英与烧碱反应:SiO2+2OH-===SiO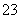 +H2O
+H2O
B.硅与烧碱反应:Si+2OH-===SiO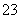 +H2↑
+H2↑
C.硅酸钠溶液中通入少量CO2:SiO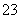 +CO2+H2O===CO
+CO2+H2O===CO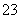 +H2SiO3↓
+H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO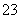 ===H2SiO3↓
===H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
| X | Y | ||
| Z | W |
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) == 2NO2(g) ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)== N2(g) + 2H2O(g) ΔH= - 534.0kJ·mol-1
2NO2(g)  N2O4(g) ΔH= - 52.7kJ·mol-1
N2O4(g) ΔH= - 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
4NH3(g)+3O2(g) ΔH= Q kJ·mol-1
 ①已知该反应的平衡常数K与温度的关系如图,则此反应的Q <
①已知该反应的平衡常数K与温度的关系如图,则此反应的Q <
0
(填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为
0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, ABC
(选填编号).
A.容器中气体的平均相对分子质量不随时间而变化 B. v(N2)/v(O2)=2∶3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
E.若向容器中继续加入N2,N2的转化率将增大
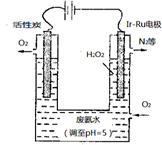 (4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约
为5,则所得废氨水溶液中c(NH4+) c(NO3-)(填“>”“<”或
“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量
为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含的离子如下表所示
| 阳离子 | NH |
| 阴离子 | OH-、NO |
取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)>c(乙)>c(丙),下列说法错误的是( )
A.甲中一定含Na+ B.乙中一定含NH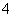
C.丙中一定含Mg2+ D.丙中一定含SO
查看答案和解析>>
科目:高中化学 来源: 题型:
取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为( )
A.2∶1∶2 B.2∶1∶3
C.6∶3∶2 D.3∶7∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com