
| A. | 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质A的转化率为70% | |
| D. | 2 s 时物质B的浓度为1.4 mol•L-1 |
分析 反应2s后测得C的浓度为0.6mol/L,C的物质的量=0.6mol/L×2L=1.2mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):4 2 0
变化量(mol):1.2 0.6 1.2
2s末量(mol):2.8 1.4 1.2
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$及转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:反应2s后测得C的浓度为0.6mol/L,C的物质的量=0.6mol/L×2L=1.2mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):4 2 0
变化量(mol):1.2 0.6 1.2
2s末量(mol):2.8 1.4 1.2
A.用物质A表示的反应的平均速率为$\frac{\frac{1.2mol}{2L}}{2s}$=0.3 mol•L-1•s-1,故A正确;
B.物质B表示的反应的平均速率为$\frac{\frac{0.6mol}{2L}}{2s}$=0.15 mol•L-1•s-1,故B错误;
C.2 s 时物质A的转化率为$\frac{1.2}{4}$×100%=30%,故C错误;
D.2s时物质B的浓度为$\frac{1.4mol}{2L}$=0.7 mol•L-1,故D错误;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意反应中物质的量关系,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 它易溶于水 | B. | 它属于芳香族化合物 | ||
| C. | 它水解可得到三种有机物 | D. | 它可以发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
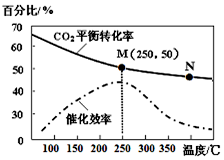 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
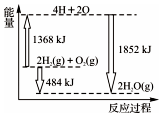
| A. | H2(g)和O2(g)反应生成H2O(g),这是个吸热过程 | |
| B. | 由2 mol H2和1 mol O2变成4 mol H、2 mol O原子,这是个放热过程 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 KJ能量 | |
| D. | 4 mol H、2 mol O生成2 mol H2O(g),共放出484 KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它在周期表的第5周期,第IA族 | |
| B. | 氢氧化铷是弱碱,是一种离子化合物 | |
| C. | 铷的一种核素${\;}_{37}^{86}$Rb原子核内的中子数与电子数之差49 | |
| D. | 在钠、钾、铷三种单质中,铷的熔点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 变成
变成 ,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | 只有CH3COOH | B. | CO2和 CH3COCH3 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为2 | B. | 质子数为2 | C. | 质子数为3 | D. | 质量数为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com