
| A. | 6.02×1023个碳-12原子就是阿伏加德罗常数 | |
| B. | 1mol氧含6.02×1023个O2分子 | |
| C. | 1molCaCl2中含3mol离子 | |
| D. | 0.5molCl2含1mol氯 |
分析 A.阿伏加德罗常数的近似值为6.02×1023;
B.“1mol氧”指代不明确;
C.氯化钙由钙离子与氯离子构成,1molCaCl2中含1mol钙离子、2mol氯离子;
D.“1mol氯”指代不明确.
解答 解:A.12g碳-12含有的碳原子数目为阿伏伽德罗常数,阿伏加德罗常数的近似值为6.02×1023,故A错误;
B.使用物质的量应指明具体的物质或微粒,应是1mol氧气含6.02×1023个O2分子,故B错误;
C.氯化钙由钙离子与氯离子构成,1molCaCl2中含1mol钙离子、2mol氯离子,共含有3mol离子,故C正确;
D.0.5molCl2含1mol氯原子,故D错误,
故选:C.
点评 本题考查物质的量及有关计算、阿伏伽德罗常数,比较基础,注意使用物质的量应指明具体的物质或微粒.


科目:高中化学 来源: 题型:解答题
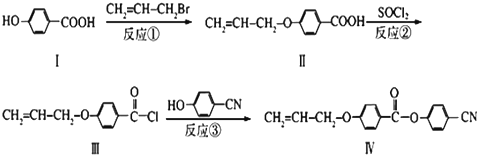

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molH2的质量是1 g | |
| B. | 1 mol HCl的质量是36.5 g•mol-1 | |
| C. | Cl2的摩尔质量等于它的相对分子质量 | |
| D. | SO42-的摩尔质量是96 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应是还原反应 | |
| B. | 在氧化还原反应中不一定所有的元素的化合价都发生变化 | |
| C. | 做氧化剂的物质不能是还原剂 | |
| D. | 发生还原反应的元素对应产物是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
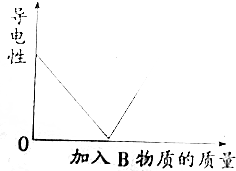 向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )
向某A溶液中加入一种物质B,其导电能力变化与加入B物质的质量关系符合如图曲线的是( )| A. | 盐酸中滴加Ba(OH)2溶液至过量 | |
| B. | CaCl2溶液中滴加浓Na2CO3溶液至过量 | |
| C. | AgNO3溶液中滴加NaCl溶液至过量 | |
| D. | 稀硫酸中滴加Ba(OH)2溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
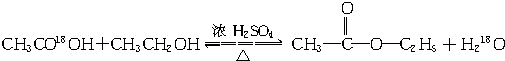 .
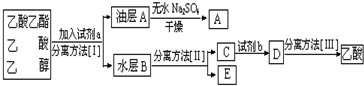
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com