
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
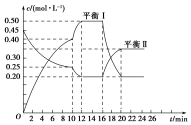 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示.请回答下列问题:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
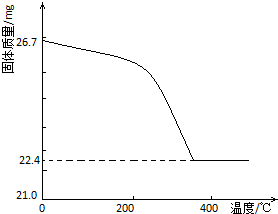 工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,… |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
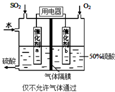 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与其他分散系最本质的区别是分散质粒子的直径介于1-100 nm之间 | |
| B. | 胶体和溶液都一定是均一透明的分散系,可以用丁达尔效应来鉴别 | |
| C. | 制备Fe(OH)3胶体的操作为,在沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热 | |
| D. | 用过滤的方法可以将胶体和溶液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75mL 2mol•L-1FeCl3溶液 | B. | 25mL 2mol•L-1KCl溶液 | ||
| C. | 150mL 1mol•L-1NaCl溶液 | D. | 20mL 1.5mol•L-1 MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 480mL | B. | 1000mL | C. | 100mL | D. | 500mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com