
| A. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| B. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| C. | 1.0L的0.1 mol•L-1Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
分析 A、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
B、合成氨的反应为可逆反应;
C、硫离子为弱酸根,在溶液中会水解;
D、标况下四氯化碳为液态.
解答 解:A、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠失去0.1NA个电子,与产物无关,故A正确;
B、合成氨的反应为可逆反应,不能进行彻底,故得到的氨气分子个数小于NA个,故B错误;
C、硫离子为弱酸根,在溶液中会水解,故溶液中的硫离子的个数小于0.1NA个,故C错误;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 | B. | Na2CO3 | C. | Ca(OH)2 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷的密度比水大,且难溶于水 | B. | 己烷在光照时能发生取代反应 | ||
| C. | 己烷在光照时能发生加成反应 | D. | 己烷不易燃烧,可作为灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的碱性减弱,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗0.1molO2则阳极理论上生成0.2molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 把锌片放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
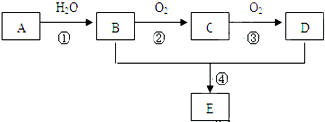
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子方向:Zn→Cu | |
| B. | Cu电极逐渐溶解 | |
| C. | Zn电极上发生还原反应 | |
| D. | 盐桥中装有含氯化钾的琼脂,Cl-向右池移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| C. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com