
【题目】某恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
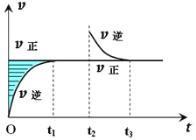
A. Z和W在该条件下至少有一个是为气态
B. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
C. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等
D. 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
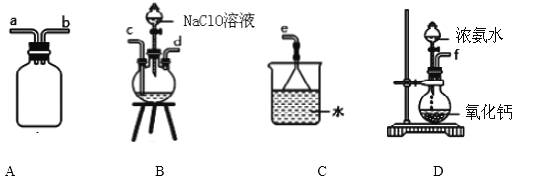
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理使用食品添加剂既不会影响人体健康,又能有效改善食物品质和色、香、味,但有 些物质严禁用作食品添加剂.下列做法正确的是( )
A.二氧化硫用作银耳的漂白剂B.胡萝卜素用作饮料的调味剂
C.次氯酸钠用作饼干的膨松剂D.苯甲酸钠用作火腿肠的防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氢气通入10 g 氧化铜粉末加热片刻,冷却后剩余固体的质量为8.4 g,下列计算正确的是
A. 有1.6 g 水生成
B. 有8.4 g 铜生成
C. 有80%的氧化铜被还原
D. 实验时所消耗的氢气不足0.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
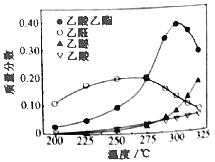
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明硅酸的酸性弱于碳酸的实验事实是
A. CO2溶于水形成碳酸,SiO2难溶于水
B. CO2通入可溶性硅酸盐溶液中析出硅酸沉淀
C. 高温下SiO2与碳酸盐反应生成CO2
D. 氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素⑦的原子结构示意图为_____;元素⑩的名称为______;
(2)在这些元素中,化学性质最活泼的金属元素是____(填元素符号,下同),最不活泼的元素是___;原子半径最小的元素是_____;
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是___(填化学式,下同);具有两性的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取 9 g 淀粉溶于水,测定淀粉的水解百分率,其程序如下:
![]()
(1)各步所加的试剂A为__________,B__________,C__________。
(2)________(填“可以”或“不可以”)只加A溶液而不加B溶液,原因是____________________。
(3)当析出2.16g单质沉淀时,淀粉的水解率为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写
(1)氨气的电子式:_________,乙炔的结构简式:___________;
(2)工业上利用乙烯催化水化法制取乙醇,化学反应方程式:________反应类型:____________
(3)苯与浓硝酸在50~60℃下发生硝化反应:________反应类型:_____________;
(4)已知键能如下:
化学键 | H—H | N—N | N—H | N≡N |
键能kJ/mol | 432 | 247 | 389 | 942 |
写出N2和H2合成NH3的热化学方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com