
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②④⑤ |
分析 既能和酸反应又能和碱反应的化合物有两性氧化物、两性氢氧化物、弱酸的酸式盐、弱酸弱碱盐等,据此解答.
解答 解:①Al能与酸、碱反应,但属于单质,不符合题意,故错误;
②Al2O3 为两性氧化物,与酸反应:Al2O3+6HCl=2AlCl3+3H2O,也能与碱反应:Al2O3+2NaOH=2NaAlO2+H2O,故正确;
③Al(OH)3 为两性氢氧化物,与酸反应:Al(OH)3+3HCl=AlCl3+3H2O,也能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,故正确;
④NaHCO3 为弱酸的酸式盐,与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑,也能与碱反应:NaHCO3+NaOH=Na2CO3+H2O,故正确;
⑤(NH4)2CO3与盐酸反应生成氯化铵和二氧化碳和水,与氢氧化钠反应生成一水合氨和碳酸钠,故正确;
故选:B.
点评 本题考查常见物质的性质,掌握既能和酸反应又能和碱反应的物质类型是解题关键,注意对相关知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2固体中阳离子与阴离子的个数比为1:1 | |
| B. | 从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中 | |
| C. | 将Na投入饱和Na2CO3溶液中,会导致溶液质量增加 | |
| D. | 金属Na失火,可用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. | 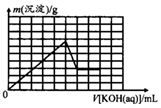 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
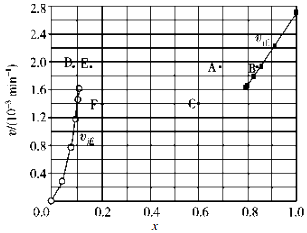 (1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ②④ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
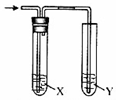 用图所示装置进行相关实验,能达到实验目的是( )
用图所示装置进行相关实验,能达到实验目的是( )| 实验 | 试剂X | 试剂Y | |
| A | 检验乙醇与浓硫酸共热产生的乙烯 | NaHSO3溶液 | KMnO4酸性溶液 |
| B | 检验CO2和SO2混合气体中的CO2 | 品红溶液 | 澄清的石灰水 |
| C | 除去Cl2中混有的HCl,并验证Cl2的漂白性 | 饱和NaCl溶液 | 品红溶液 |
| D | 通入 HCl,验证非金属性Cl>C>Si | NaHCO3溶液 | Na2 SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
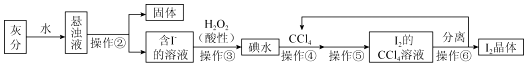
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的命名为:2-甲基-3-乙基丁烷 | |
| B. | 分子式为 C4H8O2的酯有 4 种 | |
| C. | 乙烯分别使溴水和酸性 KMnO4 溶液褪色,反应类型相同 | |
| D. | 油脂是能发生水解反应的高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com