
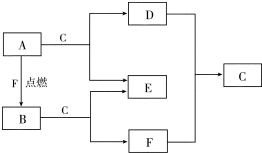
 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.
分析 A、D、F均是由短周期元素组成的单质,常温下C是液体为H2O,A点燃和F单质反应生成的B与水反应生成F,证明F为O2,A为Na,B为Na2O2,E为NaOH,D为H2,据此分析问题,
(1)B为过氧化钠为钠离子和过氧根离子构成的离子化合物;
(2)A与C的反应为钠和水反应生成氢氧化钠和氢气;
(3)A为Na,为活泼金属,具有很强的还原性,焰色反应为黄色,钠和水、二氧化碳等发生反应;
(4)依据化学方程式定量关系计算电子转移,过氧化钠中氧元素化合价-1价变化为0价和-2价;
(5).根据反应物的量先判断金属与酸哪种过量,按不足量计算.钠与酸反应完会继续与水反应;
解答 解:A、D、F均是由短周期元素组成的单质,常温下C是液体为H2O,A点燃和F单质反应生成的B与水反应生成F,证明F为O2,A为Na,B为Na2O2,E为NaOH,D为H2,据此分析问题,
(1)过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,
,
故答案为: ;
;
(2)A与C的反应为钠和水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2Na++2OH+H2↑,
故答案为:2Na+2H2O=2Na++2OH+H2↑;
(3)A为Na,为活泼金属,具有很强的还原性,焰色反应为黄色,钠和水、二氧化碳等发生反应,
①A为Na为活泼金属,有很强的还原性,故①正确;
②钠元素的焰色反应呈黄色,故②错误;
③钠和水发生剧烈反应,少量钠可以保存在煤油里,故③错误;
④钠和二氧化碳能发生反应,钠着火时不能用泡沫灭火剂,应用沙子盖灭,故④错误
故答案为:①;
(4)在B和C的反应中,若生成标准状况下气体5.6L物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,则该反应转移的电子依据化学方程式定量关系计算得到,2Na2O2+2H2O=4NaOH+O2,过氧化钠中氧元素化合价-1价变化为0价和-2价,生成1mol氧气电子转移2mol,生成0,25mol氧气电子转移0.5mol,
故答案为:0.5;
(5)将三种金属各0.3mol分别投入100mL 1mol/L的盐酸中,铝、铁只能和HCl反应,可知铝、铁过量,应按HCl的物质的量计算,铁、铝产生氢气物质的量相等,从氢离子到氢气,根据氢元素守恒,则产生氢气的物质的量为:(0.1L×1mol/L)×$\frac{1}{2}$═0.05 mol.但金属钠活泼,能与水反应生成氢气,因此钠少量,生成氢气的量根据钠的物质的量进行计算,0.3mol钠产生0.15mol氢气.故将钠、铁、铝各0.2mol 分别放入100mL 1mol/L的盐酸中,产生氢气的物质的量之比为:0.15mol:0.05mol:0.05mol═3:1:1,所以同温同压下产生的气体体积比是3:1:1,
故答案为:③;
点评 本题考查钠及其化合物性质、电子式书写、氧化还原反应电子转移、根据方程式进行的计算,题目难度中等,注意对基础知识的理解掌握.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 有甲酸乙酯和甲酸 | B. | 有甲酸乙酯和乙醇 | ||
| C. | 有甲酸乙酯,可能有乙醇 | D. | 几种物质都有 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
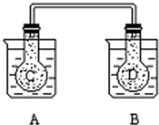 如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00
如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. | 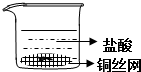 | D. | 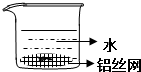 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
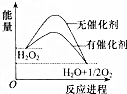 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+O2;△H=-Q1 kJ•mol-1 | |
| D. | 加入催化剂,减小了反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ClO-作氧化剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
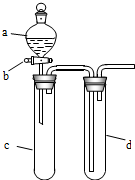 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com