
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用题9图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量碱性测定。
 (1)仪器A的名称是_______,水通入A的进口为_________。
(1)仪器A的名称是_______,水通入A的进口为_________。
(2)B中加入300.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择题9中图2中的_____;若滴定终点时溶液的pH=8.8,则选择的指示剂为__________;若用50ml滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)____(①=10ml,②=40ml,③<10ml,④>40ml)
(4)滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为:__g/L。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_______。
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
按下图所示的装置进行实验:

(1)实验开始一段时间后,可观察到锥形瓶瓶口上方有白烟生成,请补充可能观察到的其他现象:______________________________________________;
有关化学方程式为__________________________________________________。
(2)由于气温的原因,上述实验一段时间后现象不太明显,需要向锥形瓶内加入下列哪种物质才能重新看到明显的现象?________。
A.NaOH B.CaO
C.浓H2SO4 D.NH4Cl
(3)经过对比实验证明,在其他条件相同时,用空气代替氧气的实验效果较差,主要原因是________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在铁和氧化铁的混合物15 g中加入150 mL稀H2SO4放出氢气1.68 L(标准状况下)。当反应停止后,铁与氧化铁均无剩余,且溶液中没有Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol·L-1NaOH溶液200 mL。
(1)写出溶液中反应的化学方程式:
_____________________________________________________;
_____________________________________________________;
_____________________________________________________。
(2)混合物中铁的质量为________,氧化铁的质量为________。
(3)稀H2SO4的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C三种烃,其球棍模型如下图:
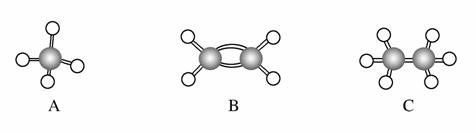
(1)等质量的以上物质完全燃烧时消耗O2的量最多的是________(填选项字母,下同),该烃与氧气反应的化学方程式为________________________________________________________。
(2)相同状况、等体积的以上三种物质完全燃烧时消耗O2的量最多的是________,该烃电子式为____________________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
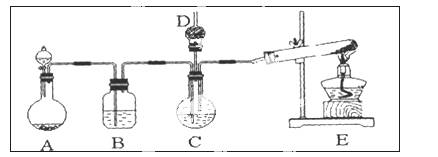
(1)A中制备气体时,所需药品是(选填字母序号) ;
(2)B中盛有饱和碳酸氢钠溶液,其作用是 ;
(3)写出制取氨气的化学方程式 ;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式 ;
(5)检验D出口处是否有氨气逸出的方法是 ;
(6)写出制纳米级碳酸钙的化学方程式 。
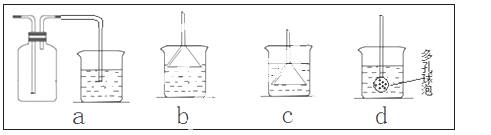
(7)若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
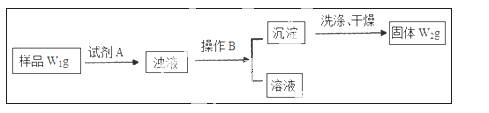
试回答:
(1)所加试剂A的化学式为
(2)B操作方法是
(3)样品中氯化铵的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反
应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O 下表列出了相关金
属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Al3+ | 3. 0 | 5. 0 |
| Fe2+ | 5. 8 | 8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
 (3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚 铁晶体。分离过程中加入无水乙醇的目的是
。
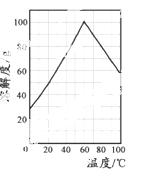
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先 制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4 溶液, ,得到FeSO4·7H2O 晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2⇌2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时,生成2n mol NO;
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态.
|
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列各小题
(1)按系统命名法,化合物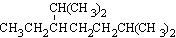 的名称是____________________。
的名称是____________________。
(2)蛋白质是构成生命的基础物质,而氨基酸又是构成蛋白质的基石,最简单的氨基酸其
结构简式是 ;该氨基酸形成的二肽的结构简式是 ;将该氨基酸溶于酸性溶液形成的微粒的结构简式是 ;将该氨基酸溶于碱性溶液形成的微粒的结构简式是 ;固态氨基酸主要以内盐形式存在,该氨基酸的内盐的结构简式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com