
【题目】现有一种泉水,取0.5 L这种泉水作为样品,经测定该样品中含有48.00 mg的Mg2+。 那么,该泉水中Mg2+的物质的量的浓度是多少?为使该泉水样品所含的Mg2+全部沉淀,应加入1mol/L NaOH溶液的体积是多少?(请写出简要计算过程)
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
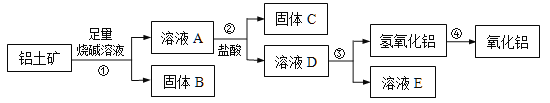
(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是 ; ;
第③步中,生成氢氧化铝的化学方程式是 。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是_______。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1 mol电子,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关胶体与溶液的说法正确的是
A. 胶体粒子带电,溶液溶质粒子不带电
B. 渗析实验可以鉴别胶体和溶液
C. 胶体与溶液都可以通过滤纸、半透膜和分子筛
D. 丁达尔效应可以区分胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应分别是
①_____________________________________;
②_____________________________________。
(3)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①负极的电极反应_______________________.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_____________。
(4)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
(5)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。

请回答:a为________(填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)为:______________;写出此时电解反应的总化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭的容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容器扩大到原来的两倍,在达平衡时,测得A的浓度降低为0.5 mol/L.下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容器扩大到原来的两倍,在达平衡时,测得A的浓度降低为0.5 mol/L.下列有关判断正确的是
A. x+y<z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量氨气溶于适量的水中,下述不能说明达到电离平衡的是
A.溶液中氮元素的总浓度不再变化
B.溶液中铵根离子的浓度不再变化
C.溶液中氢离子的浓度不再变化
D.溶液中氢氧根离子的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2S是一种无色、有臭鸡蛋气味的气体、有剧毒。是一种大气污染物。它的燃烧热△H=-a kJ/mol, 写出H2S燃烧热的热化学方程式为:____________。
(2)己知:Mg(s)+ 2 H2O (g)= Mg(OH )2(s)+H2(g)△H1=441- kJ/mol、H2O(g)=1/2H2(g)+O2(g)△H2=242kJmol-1、Mg(s)+1/2O2(g)=MgO(s)△H3=-602kJmol-1。
①Mg(OH )2分解的热化学方程式为:__________________。
②Mg(OH )2可以作为阻燃剂的原因(写一条即可)_____________。
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。针对此现象,某同学认为该反应放热,温度升高,反应速率加快。
①从影响反应速率的因素看,你的猜想还可能是_____________的影响
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,可以在反应一开始时加入
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
(4)已知化学反应:①Fe(s)+CO2(g)![]() FeO(s)+CO(g);②:Fe(s)+H2O(g)
FeO(s)+CO(g);②:Fe(s)+H2O(g)![]() FeO(s)+H2(g);③:CO2(g)+H2(g)
FeO(s)+H2(g);③:CO2(g)+H2(g)![]() CO(g)+H2O(g)。三个反应的平衡常数分别为K1、K2和K3。推断反应③为△H3____0(填“ > ”成“ < ”),根据反应①和反应②可推导出K1、K2和K3的关系式:_______________。
CO(g)+H2O(g)。三个反应的平衡常数分别为K1、K2和K3。推断反应③为△H3____0(填“ > ”成“ < ”),根据反应①和反应②可推导出K1、K2和K3的关系式:_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b.的代数式表示该混合溶液中醋酸的电离常数为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)如右图所示,仪器A的名称是_______________;
(2)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃[ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_________ (填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与span>NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于_________
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1
C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com