
| A. | 二氧化碳通入过量的氢氧化钠溶液:CO2+2OH-═CO32-+H2O | |
| B. | 碳酸钙与硝酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 少量金属钠放入冷水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O═Fe(OH)3↓+3H+ |
分析 A.二氧化碳过量反应生成碳酸氢钠;
B.碳酸钙为沉淀,应保留化学式;
C.二者反应生成氢氧化钠和氢气;
D.氢氧化铁胶体不是沉淀,不能用沉淀符号.
解答 解:A.二氧化碳通入过量的氢氧化钠溶液,离子方程式:CO2+OH-═HCO3-,故A错误;
B.碳酸钙与硝酸反应,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故B错误;
C.少量金属钠放入冷水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故C正确;
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,离子方程式:Fe3++H2O═Fe(OH)3(胶体)+3H+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确离子反应实质是解题关键,注意离子反应应遵循客观事实,遵循原子个数、电荷数守恒规律,注意反应物用量对反应的影响,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去除油污能力更强 | |
| B. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火器 | |
| C. | 保存FeSO4溶液时加入少量铁粉 | |
| D. | 把AlCl3溶液加热蒸干灼烧至质量不再变化得到Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
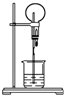 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | SO2和H2O | B. | CO2和NaOH溶液 | C. | NH3和H2O | D. | NO和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢酶、酚醛树脂、尼龙、有机玻璃、PVC都是高分子化合物 | |
| B. | 分子筛、青花瓷、黏土、硅藻土的主要成分都是硅酸盐 | |
| C. | 植物秸秆发酵制沼气、玉米制乙醇、城市与工业有机废弃物的再利用都涉及生物质能 | |
| D. | 酸碱质子理论进一步扩大了人们对酸碱的认识,可以解释一些非水溶液中进行的酸碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
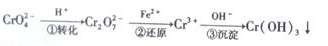
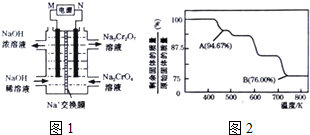
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
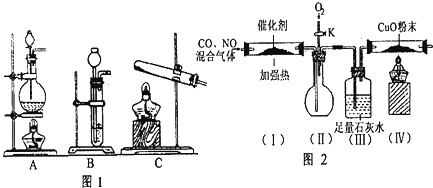
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com