
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= .
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL 18molL﹣1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
【答案】
(1)![]()
(2)6,6,A,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动,乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低
【解析】解:(1)水为纯液体,则CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O的平衡常数表达式为K=
CH3COOC2H5+H2O的平衡常数表达式为K= ![]() ,
,
所以答案是: ![]() ;
;
(2)①本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C3molL﹣1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C3mL乙醇、2mL乙酸、3molL﹣1 H2SO4,实验D3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6molL﹣1,
所以答案是:6,6;
②对照实验A和B可知:试管Ⅰ中试剂实验A比实验B多1mL18molL﹣1 浓硫酸,但是试管Ⅱ中试剂中测得有机层乙酸乙酯的厚度,实验A为5.0cm,而实验B只有0.1cm,说明浓硫酸的吸水性提高了乙酸乙酯的产率;酯化反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动,
所以答案是:A;浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动;
③乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,实验发现温度过高,乙酸乙酯的产率反而降低,是由于乙酸、乙醇都易挥发,使产率降低,或因温度过高可能发生副反应使产率降低,如乙醇在140℃,在浓硫酸催化下脱水生成乙醚,
所以答案是:乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】在某澄清透明的酸性溶液中,能共存的离子组是
A.NH4+、Cl-、Fe3+、K+B.Na+、CO32-、Ca2+、Cl-
C.MnO4-、Fe2+、Na+、SO42-D.K+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
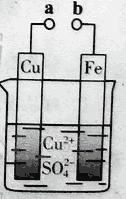
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
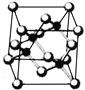
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_____________________________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因_______________________, Cu2+的核外电子排布式为_______________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有_________和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
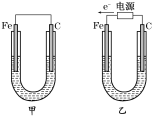
①有红色物质析出的分别是甲、乙装置中的________。
A.甲中的Fe棒,乙中的Fe棒 B.甲中的C棒,乙中的Fe棒
C. 甲中的C 棒,乙中的Fe棒 D.甲中的C棒,乙中的C棒
②乙装置中阳极的电极反应式是:____________________________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_________________________________________。
②将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:___________。
Ⅱ.如图为绿色电源“甲烷燃料电池”的工作原理示意图。
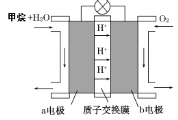
负极的电极反应为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习化学有利于我们认识饮食与健康的关系,养成良好的饮食习惯.
(1)油脂被摄人人体后,在酶的作用下水解为(写名称,下同)和 , 进而被氧化生成并提供能量,或作为合成人体所需其他物质的原料.
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取(填“蛋白质”、“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是 (填字母).
A菠菜 B花生油 C瘦肉 D西瓜
(3)某火腿制品的包装上印有相关配料:精选瘦肉、白糖、淀粉、亚硝酸钠等.火腿中属于防腐剂的是 , 不可长期或大量进食腌制肉类食品的原因是:其包装袋上常可看到如图1所示的图标,它的含义是 , 此包装袋材料是聚乙烯塑料,它的单体是(填结构简式).
(4)如图2所示4支试管同时水浴加热4min.为检验其中淀粉的水解程度,某同学的实验操
作与现象记录如下:
试管 | 操作 | 现象 |
① | 加入碘水 | 溶液变成蓝色 |
② | 加入银氨溶液,水浴加热 | 未出现银镜 |
③ | 加入碘水 | 溶液变成蓝色 |
④ | 加入银氨溶液,水浴加热 | 未出现银镜 |
①结合试管1、2中的现象,得出的结论是:这两支试管中淀粉水解(填“没有”、“部分”或“全部”),淀粉 (填“有”或“没有”)还原性.
②结合试管3、4中的现象,(填“能”或“不能”)得出“这两支试管中淀粉没有水解”的结论,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )

A.N4与N2互称为同位素
B.N4属于一种新型的化合物
C.N4化学性质比N2稳定
D.1mol N4气体转化为N2时要放出882kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.0lmol/L CH3COOH 溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
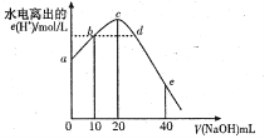
A. 从a到c,醋酸的电离始终受到促进
B. b、d两点溶液的pH相同
C. c点所示溶液中c(Na+)>c(CH3COO- )>c(OH- )>c(H+ )
D. e 点所示溶液中,c(Na+)=2c(CH3COO- )+2c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com