
分析 有A、B、C、D四种化合物,分别由NH4+、Ba2+、SO42-、HCO3-、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸,说明是A是BaSO4沉淀;
②B不溶于水,但溶于盐酸,说明B沉淀为BaSO3;
③C溶于水,溶液呈碱性,与H2SO4反应生成A是BaSO4沉淀,证明C为Ba(OH)2;
④D的溶液和C的溶液混合加热既有沉淀又有气体生成,说明是铵盐,而且生成沉淀溶于盐酸,产生无色无味的气体,说明沉淀为BaCO3,则D为NH4HCO3.
解答 解:有A、B、C、D四种化合物,分别由NH4+、Ba2+、SO42-、HCO3-、OH-中的两种组成,它们具有下列性质:
①A不溶于水和盐酸,说明是A是BaSO4沉淀;
②B不溶于水,但溶于盐酸,说明B沉淀为BaSO3;
③C溶于水,溶液呈碱性,与H2SO4反应生成A是BaSO4沉淀,证明C为Ba(OH)2;
④D的溶液和C的溶液混合加热既有沉淀又有气体生成,说明是铵盐,而且生成沉淀溶于盐酸,产生无色无味的气体,说明沉淀为BaCO3,则D为NH4HCO3 ;
推断得到A为BaSO4,B为BaSO3,C为Ba(OH)2,D为NH4HCO3 ,
(1)上述推断可知A为BaSO4,D为NH4HCO3 ,
故答案为:BaSO4;NH4HCO3 ,
(2)①B为BaSO3与盐酸反应生成氯化钡、二氧化碳和水,反应的离子方程式为:BaSO3+2H+=Ba2++H2O+CO2↑,
故答案为:BaSO3+2H+=Ba2++H2O+CO2↑;
②D与过量的C溶液混合加热生成碳酸钡,氨气和水,碳酸氢铵全部反应,反应的离子方程式为:NH4 ++HCO3-+Ba2++2OH-=BaCO3↓+2H2O+NH3↑,
故答案为:NH4 ++HCO3-+Ba2++2OH-=BaCO3↓+2H2O+NH3↑.
点评 本题考查了物质推断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把你我物质性质和反应现象的分析判断,物质检验实验方法分析,实验过程中反应现象的理解应用,物质和离子性质熟练掌握是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 图1:实验室制备Fe(OH)2 | |
| B. | 图2:从NaCl与I2的混合物中回收I2 | |
| C. | 图3:收集NO气体 | |
| D. | 图4:检验铁粉与水蒸气反应产生的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态水的密度大于冰的密度 | B. | 碘单质和干冰容易升华 | ||
| C. | 氧气的氧化性不如氯气的氧化性 | D. | 溴容易溶于四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 原子序数 | 核外电子排布式 | 外围电子排布式 | 周期表中的位置 |
| 16 | 1S22S22P63S23P4 | 3s23p4 | 第三周期第ⅥA族 |
| 23 | 1S22S22P63S23P63d34s2 | 3d34s2 | 第四周期第ⅤB族 |
| 34 | 1S22S22P63S23P63d104s24p4 | 4s24p4 | 第四周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 不锈钢是一种常见的合金,耐高温,加工性能好,在生产生活中有广泛用途.一种不锈钢的主要成分是Fe、Ni、Cr、Si、P.回答下列问题:
不锈钢是一种常见的合金,耐高温,加工性能好,在生产生活中有广泛用途.一种不锈钢的主要成分是Fe、Ni、Cr、Si、P.回答下列问题: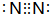 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com