
【题目】下述实验方案能达到实验目的的是
A.验证铁钉发生吸氧腐蚀
B.证明Fe电极被保护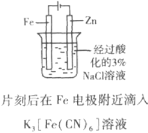
C.测定中和热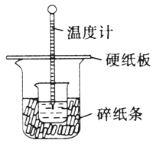
D.溶解度:Mg(OH)2>Fe(OH)3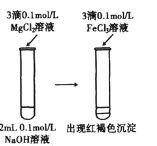
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物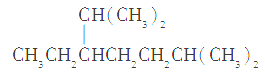 的名称为2,6二甲基-5-乙基庚烷
的名称为2,6二甲基-5-乙基庚烷
B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
C.化合物 是苯的同系物
是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
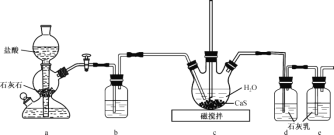
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 _________;装置b中盛放的试剂是________ 。
②装置c中的长直导管的作用是________。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是__________;该反应的化学方程式为____________________。
(3)探究硫脲的性质:①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 ______。
③可用酸性KMnO4溶液滴定硫脲,已知MnO![]() 被还原为Mn2+,CS(NH2)2被反应为CO2、N2及SO
被还原为Mn2+,CS(NH2)2被反应为CO2、N2及SO![]() ,该反应中氧化剂与还原剂的物质的量之比为_____。
,该反应中氧化剂与还原剂的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol L-1HB溶液中逐滴滴入 0.1mol L-1NaOH溶液,所得 PH变化曲线如图所示。下列说法错误的是
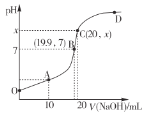
A.OA各点溶液均存在:c(B-) >c(Na+)
B.C至 D各点溶液导电能力依次增强
C.点 O时,pH>1
D.点 C时,X约为 10.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A),晶胞参数a=3.310A,b=4.380A,c=10.500A。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样,图A中编号为①的P原子的晶胞内坐标为(0.50,0.090,0.598)。请回答下列问题:
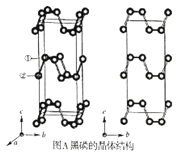
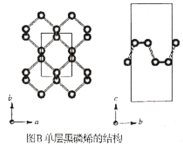
(1)写出P原子的价电子排布:___。
(2)P和F的电负性大小顺序是X(P)___X(F)。(填“<”“=”或“>”)P和F形成的分子PF3和PF5,它们的几何构型分别为__、__。
(3)①黑磷中P原子杂化类型是__。黑磷中不存在__(选填字母序号)。
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为__,原因是__。
(4)图A中编号为②的P原子的晶胞内坐标为__,黑磷的晶胞中含有__个P原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,0.1mol·L-1某一元酸(HA)溶液中 ,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
B.已知:0.1mol·L-1KHC2O4溶液呈酸性,则存在关系:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)>c(H+)>c(OH-)
C.25℃,H2SO3![]() HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
D.0.1mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。
回答下列问题:
(1)基态Ge原子价电子排布图为_______,Ge原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得______光谱(填“连续”或 “线状”),鉴定Ge元素的存在。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是______。
②推测 1molGenH2n+2中含有的σ键的数目是_____(用NA表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中 EMIM+结构如图所示。

①该物质的晶体类型是_________。
②EMIM+ 离子中组成元素的电负性由小到大的顺序是________。
(4)独立的NH3分子中H-N-H 的键角为 107.3 ,[Zn(NH3)6]2+离子中H-N-H的键角________107.3° ( 填“大于”、“小于”或“等于” )。
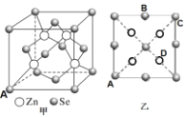
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_____;已知晶胞边长为a pm,乙图为甲图的俯视图,A点坐标为( 0,0,0),B点坐标为(![]() ,a,
,a,![]() ) ,则 D点坐标为_______;若该晶胞密度为ρ g·cm-3,则阿伏加德罗常数NA为_______(列出计算式)。
) ,则 D点坐标为_______;若该晶胞密度为ρ g·cm-3,则阿伏加德罗常数NA为_______(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,正确的是
A.某溶液加强碱并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液溶质为铵盐
B.将硝酸亚铁样品溶于稀硫酸,滴加硫氰化钾溶液,溶液变为血红色,可推知该样品已经氧化变质
C.往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干,得到FeCl3固体
D.向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,证明Na2CO3溶液中存在水解平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com