
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量盐酸,c(H+)增大,Kw不变 | |
| C. | 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低 | |
| D. | 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大 |
分析 水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小.
解答 解:A.水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小,故A错误;
B.向水中加入少量盐酸,抑制水的电离,c(H+)增大,平衡逆向进行,温度不变Kw不变,故B正确;
C.向水中加入少量固体NaOH,c(OH-)增大,平衡逆向移动,c(H+)降低,故C错误;
D.向水中加入AlCl3固体,溶解后铝离子水解促进水的电离,平衡正向移动,c(OH-)浓度减小,c(H+)浓度增大,故D错误;
故选B.
点评 本题考查水的电离平衡移动,题目难度不大,注意从浓度、温度对平衡移动的影响角度分析,本题易错点为A,注意升高温度c(H+),pH减小.


科目:高中化学 来源: 题型:选择题
| A. | 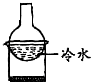 加热烧杯,除去NH4Cl中混有的I2 | B. | 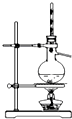 分离溴苯与苯的混合物 | ||
| C. | 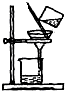 分离淀粉与葡萄糖的混合液 | D. | 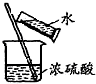 稀释浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2与Cl2反应的离子方程式为:I2+5Cl2+6H2O=2IO3-+12H++10Cl- | |
| B. | 当a=3b时,发生反应的离子方程式为:I-+3Cl2+3H2O=IO3-+6Cl-+6H+ | |
| C. | 当a=2b时,发生反应的离子方程式为:5I-+10Cl2+9H2O=3IO3-+20Cl-+I2+18H+ | |
| D. | 若反应后溶液中I2与IO3-的物质的量之比为1:1,则反应中转移电子3.5bmol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2O | H2S | H2Se | H2Te |
| 100℃ | -60.75℃ | -41.5℃ | -1.8℃ |
| A. | 氧族元素氢化物沸点高低与范德华力的大小无关 | |
| B. | 范德华力一定随相对分子质量的增大而减小 | |
| C. | 水分子间可能还存在一种特殊的分子间作用力 | |
| D. | 水分子间存在共价键,加热时较难断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H216O | B. | 1H218O | C. | 2H216O | D. | 2H218O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com