
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为_______,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为________________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(夹持装置未画出)。

①仪器A的名称为___________,装置乙中装入的试剂_____________,装置B的作用是_______________________。
②装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 mol/L浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。
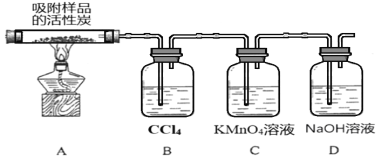
①加热时A中试管出现黄绿色,装置B的作用是 ____________。
②装置C中的现象是___________,反应的离子方程式为___________________。
【答案】+6 SO2Cl2+2H2O=2HCl↑+H2SO4 (球形)冷凝管 浓硫酸 防止空气中水蒸汽进入三颈烧瓶,使SO2Cl2发生水解变质;吸收尾气SO2和Cl2,防止污染环境。 D 吸收Cl2 C中KMnO4溶液褪色 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】
(1)根据化合物中正负化合价的代数和为0判断S元素的化合价,SO2Cl2在潮湿空气中因水解“发烟”,生成的HCl溶于水,呈现白雾。;
(2)①根据图示仪器的结构特点可知仪器的名称,乙中浓硫酸可干燥氯气,装置B中碱石灰可吸收尾气;
②通过滴加液体,排除装置中的氯气,使氯气通过装置乙到装置甲中;
(3)①加热时A中试管出现黄绿色,装置B中四氯化碳可吸收生成的氯气;
②装置C中二氧化硫与高锰酸钾反应。
(1)SO2Cl2中S的化合价为0-(-1)×2-(-2)×2=+6,SO2Cl2在潮湿空气中因水解“发烟”,生成了HCl,其化学方程式为SO2Cl2+2H2O=2HCl↑+H2SO4;
(2)①仪器A的名称为(球形)冷凝管,装置乙中装入的试剂为浓硫酸,装置B的作用是防止空气中水蒸汽进入三颈烧瓶,使SO2Cl2发生水解变质,吸收尾气SO2和Cl2,防止污染环境;
②氯气不溶于饱和食盐水,通过滴加饱和食盐水,将氯气排出,其它均不符合,故合理选项是D;
(3)SO2Cl2分解生成了Cl2,根据化合价Cl的化合价升高,化合价降低只能是S元素,S从+6降低到+4,生成SO2。
①加热时A中试管出现黄绿色,说明生成了Cl2,装置B的作用是吸收Cl2;
②装置C中的现象是KMnO4溶液褪色,SO2与KMnO4反应,反应的离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:H2S+Fe2(SO4)3 =S↓+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。

方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+ H2O (l) =Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理______________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_____________。
)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要含3Al2O3·2SiO2、SiO2,还含有少量CaO、Fe2O3等物质)为原料制取Al2O3的流程如图:
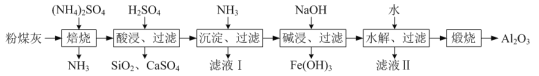
(1)当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=![]() )不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
)不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
(2)“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3的离子反应方程式为___。
(3)“碱浸”加入NaOH发生反应的离子方程式为___。
(4)“水解、过滤”可得到Al(OH)3沉淀,升高温度有利于水解的原因是___。该步骤可将加水改成通入过量的___气体。
(5)流程中,可以回收并循坏利用的物质除NH3外,还有___和___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为________。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因________________。
(3)H2Se分子的键角_______H2O分子的键角(选填“>”、“=”或“<”)。写出与SeO3互为等电子体的一种阴离子_____________(写化学式)。
(4) AsF3分子的立体构型为__________;AsF3是极性分子,理由是_________________。
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有__________________。
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:

金刚砂中硅原子的杂化轨道类型为_______,沿晶胞图中虚线方向的切面图为__________(填标号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。任务1:利用如图所示装置探究NO2能否被NH3还原(夹持固定装置已略去)。
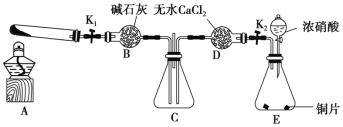
请回答下列问题:
(1)E装置中制取NO2的化学方程式是_____________________________。
(2)此实验装置存在的一个明显缺陷是_______________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(3)实验前,该小组同学提出三种假设。
假设1:二者不反应;假设2:NO2能被Na2O2氧化;
假设3:________________________________________________。
(4)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

①装置的合理连接顺序是(某些装置可以重复使用)_________________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________。
(2)如图中表示O2变化曲线的是________,用O2表示从0~2s内该反应的平均速率v=________。
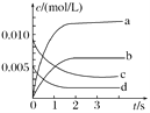
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A.标准状况下,2.24LH2O分子中共价键的数目为0.2NA
B.1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C.N2(g)+3H2(g)![]() 2NH3(g) △H=-92 kJ·mol-1,若放出92kJ能量,生成NH3 2NA
2NH3(g) △H=-92 kJ·mol-1,若放出92kJ能量,生成NH3 2NA
D.0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.
(1)铁、钴、镍都是很好的配位化合物形成体.
①[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。写出Co2+的价层电子排布图__.[Co(H2O)6]2+中Co2+的配位数为__。NH3分子的中心原子杂化方式为__,H2O分子的立体构型为__。
②铁、镍易与一氧化碳作用形成羰基配合物,如:Fe(CO)5,Ni(CO)4等.CO与N2属于等电子体,则CO分子中σ键和π键数目比为__,写出与CO互为等电子体的一种阴离子的离子符号__。
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价.NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO__FeO(选填“<”“>”“=”);某种天然NiO晶体存在如图所示缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性.某氧化镍样品组成为Ni0.97O.该晶体中Ni3+与Ni2+的离子数之比为__。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com