
(12分)X、W、Y、Z均为短周期主族元素,原子序数依次增大,Y原子的最外层电子数是X的2倍,X、W、Y在周期表中的相对位置如下图所示。
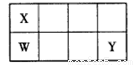
回答下列问题:
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y、Z两种元素的非金属性强弱(用化学方程式表示): 。
(3)W的最高价氧化物与强碱溶液反应的离子方程式为 。
(4)X的最高价氧化物对应水化物 ( H3XO3 ) 是一元弱酸,在横线上填写合适的结构简式:
X (OH)3 + H2O H++
H++
(5)已知25℃:
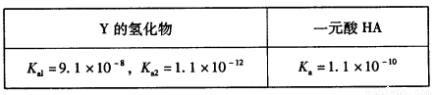
写出Y的氢化物与钾盐KA溶液(A-表示酸根)反应的化学方程式: 。
(6)在烧碱溶液中,以W单质和NiO(OH)(氢氧化氧镍)为两极组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,写出其正极的电极反应式: 。
(1)第三周期VIA族;(2)Cl2+Na2S=S↓+2NaCl等(2分);
(3)Al2O3+2OH-=2AlO2-+H2O(2分);(4) 或B(OH)4-或[B(OH)4]-(2分);
或B(OH)4-或[B(OH)4]-(2分);
(5)H2S+KA=KHS+HA(2分);(6)NiO(OH)+e-+H2O=Ni(OH)2+OH-(2分)
【解析】
试题分析:同一主族的元素的原子最外层电子数相等,原子的最外层电子数等于族序数,假设X的最外 层电子数是m,则Y的最外层电子数是m+3,根据题意可得2m=m+3,所以m=3。因此X是B,W是Al;Y是S,Z是Cl。(1)16号S元素在元素周期表中的位置是第三周期VIA族;(2)元素的非金属性越强,其单质的氧化性就越强。活动性强的可以把活动性弱的从化合物中置换出来。如Cl2与Na2S发生置换反应:Cl2+Na2S=S↓+2NaCl,就可以证明单质的氧化性:Cl2>S,也就证明的元素的非金属性:Cl>S。(3)Al元素处于金属与非金属的交界区,其相应的最高价氧化物具有两性,能够与强碱溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;B的最高价氧化物对应水化物 ( H3XO3 ) 是一元弱酸,其电离的方程式是:X (OH)3 + H2O H+ + B(OH)4-;(5)根据电离平衡常数可知K(H2S)>K(HA)>K(HS-),所以Y的氢化物与钾盐KA溶液 ( A-表示酸根 ) 反应的化学方程式是H2S+KA=KHS+HA;(6)在烧碱溶液中,Al单质和NiO(OH) (氢氧化氧镍)为两极组成一种新型电池,Al为负极,NiO(OH)为正极。放电时NiO( OH )转化为Ni(OH)2,其正极的电极反应式是NiO(OH)+e-+H2O=Ni(OH)2+OH-。
H+ + B(OH)4-;(5)根据电离平衡常数可知K(H2S)>K(HA)>K(HS-),所以Y的氢化物与钾盐KA溶液 ( A-表示酸根 ) 反应的化学方程式是H2S+KA=KHS+HA;(6)在烧碱溶液中,Al单质和NiO(OH) (氢氧化氧镍)为两极组成一种新型电池,Al为负极,NiO(OH)为正极。放电时NiO( OH )转化为Ni(OH)2,其正极的电极反应式是NiO(OH)+e-+H2O=Ni(OH)2+OH-。
考点:考查元素的推断、元素在周期表中的位置、元素非金属性强弱比较、物质反应的离子方程式和电离方程式的书写、原电池反应原理的应用的知识。
考点分析: 考点1:物质的结构与性质 考点2:元素周期律与元素周期表 试题属性

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 稳定性:盐酸>硅酸 |
B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe3+,没有Fe2+ |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫色 | 碘在CCl4中的溶解度较大 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Ca2+、H+、Cl-、HCO3- B.H+、K+、S2-、ClO-
C.Fe2+、Na+、SO42-、NO3- D.Cu2+、Ag+、SO42- 、OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:填空题
(16分)非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
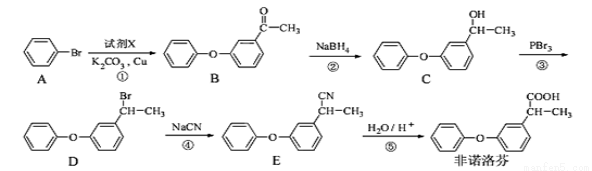
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)在上述五步反应中,属于取代反应的是 (填序号)。
(3)若过程①生成的另一种产物有HBr,写出由A到B发生反应的化学方程式 。
(4)非诺洛芬的一种同分异构体满足下列条件:
I.分子中含有两个苯环
II.能与NaHCO3反应放出CO2,能与 FeCl3溶液发生显色反应。
III.分子中有6 种不同化学环境的氢,且各种氢原子个数比为6:2:2:2:1:1。
写出符合条件的一种同分异构体的结构简式: 。
(5)下面为以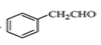 为原料制备
为原料制备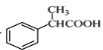 的部分合成路线流程图。
的部分合成路线流程图。
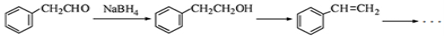
①写出由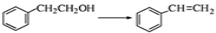 的反应方程式 ;
的反应方程式 ;
②根据已有知识并结合相关信息把合成路线流程图补充完整(无机试剂任选,在箭头上写出参与反应的物质及反应条件)
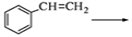 。
。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法不正确的是
A.1L 0.1 mol·L-1NH4NO3溶液中含有0.1nA个NO3-
B.常温常压下,2.2g 14CD4含有nA个质子
C.常温下,将1 mol Fe投入足量浓硝酸中,转移3nA个电子
D.标准状况下,11.2L的CO和N2的混合气体含有nA个原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
汽车尾气净化中的一个反应如下:NO(g)+CO(g)=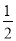 N2(g)+CO2(g) ΔH=-373.4KJ/mol
N2(g)+CO2(g) ΔH=-373.4KJ/mol
若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是
A.其它条件不变,加入催化剂,ΔH变大
B.及时除去二氧化碳,正反应速率加快
C.降低温度,可提高反应物的转化率
D.若气体的密度保持不变,说明平衡不发生移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列叙述正确的是
A.1 L 0.1 mol·L-1氨水中含有0.1 NA个OH-
B.1 mol SO2和CO2的混合气体中含有2NA个氧原子
C.1 mol—OH (羟基) 与l mol OH-均含有10个NA e-
D.在标准状况下,22.4 L四氯化碳中含有NA个分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:填空题
选做(12分)【化学——物质的结构】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO简写为Ac)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的电负性从大到小排列顺序为 。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。
a.离子键 b.配位键 c.σ键 d.π键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。

①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是 。
a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:填空题
(14分)锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题:

(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4-在该pH范围内反应的主要产物。
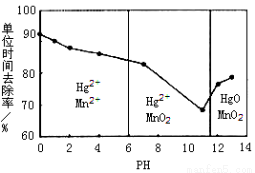
①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com