
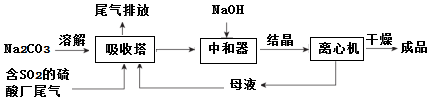
分析 利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,吸收塔中发生的反应为2CO32-+SO2+H2O=2HCO3-+SO32-,为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的,加入氢氧化钠进入中和器得到溶液结晶进入离心机干燥得到晶体,滤液重新进入吸收塔循环使用,
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施有控制SO2流速、增大Na2CO3溶液的浓度、适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等;
(2)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠;
(3)①由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠;
②电解法可分离NaHSO3与Na2SO3混合物,阳极发生氧化反应,失去电子生成氧气,氢离子和亚硫酸根离子反应生成亚硫酸氢根离子,阴极发生还原反应生成氢气,导致HSO3-?H++SO32-正向移动,NaHSO3转化为Na2SO3;
(4)分析曲线,处于曲线上的点为饱和溶液状态,根据不同温度所得晶体不同分析;
(5)依据选项中的溶液性质和二氧化硫反应的过程和化学方程式定量关系分析计算.
解答 解:(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施有:控制SO2流速、增大Na2CO3溶液的浓度、适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等;
故答案为:控制SO2流速、增大Na2CO3溶液的浓度(适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等);
(2)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠,发生的离子方程式为:HSO3-+OH-=SO32-+H2O;
故答案为:HSO3-+OH-=SO32-+H2O;
(3)①由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应反应方程式为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
故答案为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
②通过电解法可分离NaHSO3与Na2SO3混合物,阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3.阴极2H+-2e-=H2↑,导致HSO3-?H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3,实现Na2SO3的循环利用;
故答案为:阳极4OH--4e-=2H2O+O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3;阴极2H+-2e-=H2↑,导致HSO3- H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3;
(4)A.处于曲线上的点为饱和溶液状态,A点在曲线上方,应为过饱和溶液,故A错误;
B.B点为生成晶体的转折点,两种晶体可以共存,故B正确;
C.由于冷却至33℃以下时析出Na2SO3•7H2O,应在维持95~100℃蒸发浓缩至有大量晶体析出,再利用余热蒸干,故C错误;
故答案为:B;
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,
A.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
B.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
C.Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;
D.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;
吸收量最多的是Ba(NO3)2;
故答案为:C.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、信息获取与迁移运用等,需要学生具备扎实的基础.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸雨有很大的危害,应提倡工厂使用清洁能源,减少CO2的排放 | |
| B. | 木材浸过水玻璃后,具有良好的防火性能 | |
| C. | 烧碱和纯碱都属于碱 | |
| D. | 氯气泄漏后,人应逆风且往低处跑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3,该反应中的氧化剂是N2.
2NH3,该反应中的氧化剂是N2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | Si | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验操作及现象 | ④向2mL 0.2mol/L FeCl3溶液中滴入2mL1mol/L NaF溶液,溶液变无色. |
| ⑤向2mL 0.2mol/L FeCl3溶液中滴入2mL 蒸馏水,溶液颜色变浅. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com