
| A、工业可采用火法炼铜:Cu2S+O2═2Cu+SO2 每生成2mol铜,反应共转移6NA个电子 | ||
| B、P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1mol该分子中含有的共价键数目是12NA | ||
| C、一定条件下定容容器中充入3molH2(g)和1mol N2(g)发生反应:3H2(g)+N2(g)?2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA | ||
D、标准状况下,定容容器中盛有某气体纯净物,气体密度为ρg?L-1,则该物质相对分子质量为:
|
| 3mol×0.25QkJ |
| QkJ |
| 3 |
| 4 |
| M |
| Vm |
| 3mol×0.25QkJ |
| QkJ |
| 3 |
| 4 |
| M |
| Vm |
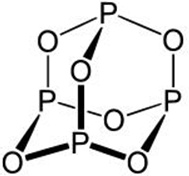 ,注意A中氧化剂有两种,为易错点.
,注意A中氧化剂有两种,为易错点.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| W | 基态原子核外有三个能级,P级能电子处在半充满状态 |
| X | 常见的金属,在周期表中的中期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 存在总质量数为56,中子数为30的核数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下11.2LN2含有的分子数为0.5N0 |
| B、9mL水和标准状况下11.2L氮气含有相同的分子数(注水的密度为1g/mL) |
| C、同温同压下,N0个NO与N0个N2和02的混合气体的体积相等 |
| D、25℃、1.01×105Pa时,11.2L氧气所含的原子数目为N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、如果M溶液呈强酸性,则N溶液中可能含有的阴离子有:OH-、NO3-、CO32- |
| B、如果M溶液呈强碱性,则N溶液中可能含有的阴离子有:MnO4-、AlO2-、SO42- |
| C、如果M溶液具有强还原性,则N溶液中可能含有的阴离子有:MnO4-、NO3-、SO42- |
| D、如果M溶液具有强氧化性,则N溶液中可能含有的阳离子有:K+、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4 |
| B、Na2CO3 |
| C、KNO3 |
| D、KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com