
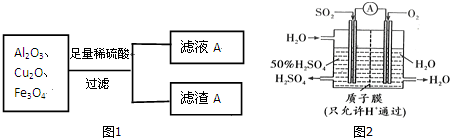
分析 (1)Cu2O与酸反应生成Cu和Cu2+,Al2O3与酸反应生成Al3+,Fe3O4与酸反应生成Fe2+、Fe3+,Fe3+与Cu反应生成Fe2+,则滤液A中含有Cu2+、Fe2+、Al3+,滤渣A中含Cu,检验铁离子用硫氰酸钾溶液;
(2)CuFeS2中Cu为+2价,S为-2价,则由化合物中元素的化合价代数和为0可知Fe为+2价,CuFeS2与氧气反应可得产物Cu2S、FeS和SO2气体,S元素的化合价升高;
(3)通入SO2和过量的空气,SO2几乎被完全吸收,生成硫酸,在负极上二氧化硫失电子生成硫酸根离子,
解答 解:(1)Cu2O与酸反应生成Cu和Cu2+,Al2O3与酸反应生成Al3+,Fe3O4与酸反应生成Fe2+、Fe3+,Fe3+与Cu反应生成Fe2+,则滤液A中含有Cu2+、Fe2+、Al3+,滤渣A中含Cu;
①由上述分析可知,滤渣A的化学成分为Cu,则上述过程中,含“铜”物质发生反应的离子方程式为Cu2O+2H+═Cu+Cu2++H2O、Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu;Cu+2Fe3+=Cu2++2Fe2+;
②Cu+2Fe3+=Cu2++2Fe2+中Cu过量,则滤液中不含Fe3+,检验方法为取少量滤液A加KSCN溶液,无现象,
故答案为:无;取少许滤液A放于小试管中,向其中滴加几滴 KSCN溶液,溶液不变为红色;
③向滤液A中加入过量NaOH溶液时,Al3+发生反应的离子方程式为Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(2)CuFeS2中Cu为+2价,S为-2价,则由化合物中元素的化合价代数和为0可知Fe为0-(-2)×2-(+2)=+2价,CuFeS2与氧气反应可得产物Cu2S、FeS和SO2气体,S元素的化合价升高,该反应的氧化产物为SO2,
故答案为:+2;SO2;
(3)通入SO2和过量的空气,SO2几乎被完全吸收,生成硫酸,化学反应为2SO2+O2+2H2O=2H2SO4,在负极上二氧化硫失电子反应生成硫酸根离子,电极反应式为SO2-2e-+2H2O=4H++SO42-,用NaOH溶液吸收SO2,所得NaHSO3溶液pH<7,溶液显酸性,说明亚硫酸根离子电离大于其水解,则该溶液中存在离子的物质的量浓度由大到小的顺序是C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-);
故答案为:SO2-2e-+2H2O=4H++SO42-,C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-);
点评 本题考查分离提纯的综合应用及金属化合物的性质,为高频考点,把握物质的性质、流程中的反应、原电池原理等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
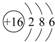 ;④的离子结构示意图
;④的离子结构示意图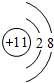 .
.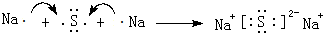 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2微溶于水,易溶于CCl4;HCl易溶于水 | |
| B. | 在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH | |
| C. | 不同的烃之间相互溶解 | |
| D. | I2易溶于KI溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
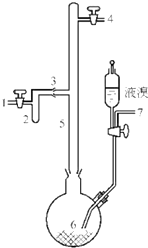 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成反应 | B. | 水解反应 | C. | 氧化反应 | D. | 消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com