
| A. | 2Al2O3+C$\frac{\underline{\;高温\;}}{\;}$4Al+3CO2↑ | B. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | ||
| C. | 2HgO$\frac{\underline{\;电解\;}}{\;}$2Hg+O2↑ | D. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2↑ |
分析 金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.总的说来,金属的性质越稳定,越容易将其从化合物中还原出来.金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,例如:2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑;
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,如:Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO2↑;
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,例如:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
解答 解:A、Al为活泼金属,通常用电解熔融的氧化铝的方法冶炼,故A错误;
B、镁在金属活动性顺序表中处于前面,用电解法制备,故B错误;
C、对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,例如:2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑,故C错误;
D、金属铁的冶炼采用还原法,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,故D正确;
故选D.
点评 本题考查金属冶炼的一般方法和原理,注意活泼性不同的金属冶炼的方法不同,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:多选题
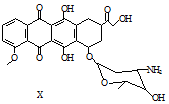
| A. | 每个X分子中含有5个手性碳原子 | |
| B. | 一定条件下,X能与乙醇发生酯化反应 | |
| C. | 一定条件下,X能发生消去反应 | |
| D. | X既能与盐酸反应,又能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.0g H218O与D2O的混合物中所含质子数、中子数均为2NA | |
| B. | 常温常压下,0.1mol/L Na2CO3溶液这所含CO32-的数目小于0.1NA | |
| C. | 用惰性电极电解CuSO4溶液,若电路中通过2NA个电子,则阳极产生11.2L气体 | |
| D. | 35℃时,1L pH=2的 H2SO4溶液中所含H+的数目和1L pH=12的NaOH溶液中所含的OH-的数目均为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气处理饮用水,在冬季的杀菌效果比在夏季好 | |
| B. | 中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈 | |
| C. | 食盐、漂白粉均可以将某些病毒氧化而达到消毒的目的 | |
| D. | 白葡萄酒含维生素C等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CHCH2OH 能发生加成反应、取代反应、氧化反应等 | |
| B. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| C. | CH3CH═CHCH3分子中所有原子在同一个平面上 | |
| D. | 结构为…-CH=CH-CH═CH-CH═CH-CH=CH-…的高分子化合物,其单体是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁、不锈钢和黄铜都属于合金 | |
| B. | 淀粉、油脂和蛋白质都属于天然高分子化合物 | |
| C. | 水泥、玻璃和陶瓷都属于无机非金属材料 | |
| D. | 天然气、液化石油气和汽油的主要成分都属于烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(5)(6) | B. | (3)(4)(5) | C. | (2)(3)(5)(6) | D. | (1)(2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
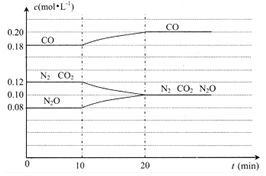 汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(N2O) | n(CO) | n(CO2) | ||
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)==C(石墨);ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH=—53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com